Giải Hóa học 12 trang 122 Kết nối tri thức
Với Giải Hóa học 12 trang 122 trong Bài 25: Nguyên tố nhóm IIA Hóa học 12 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa 12 trang 122.
Giải Hóa học 12 trang 122 Kết nối tri thức
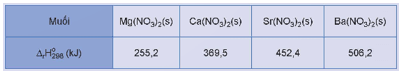
Hoạt động trang 122 Hóa học 12: Biến thiên enthalpy chuẩn của phản ứng nhiệt phân các muối nitrate của kim loại nhóm IIA:
cho trong bảng sau:
Thực hiện yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của muối nitrate của kim loại nhóm IIA.
Lời giải:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán độ bền nhiệt của các muối tăng dần theo thứ tự: Mg(NO3)2, Ca(NO3)2, Sr(NO3)2, Ba(NO3)2.
Hoạt động thí nghiệm trang 122 Hóa học 12: Phân biệt từng ion riêng rẽ Ca2+, Ba2+, SO42-, CO32- có trong dung dịch
Chuẩn bị:
Hoá chất: các dung dịch: CaCl2 1 M, BaCl2 1 M, Na2SO4 1 M, Na2CO3 1M, HCl 2 M. Dụng cụ: ống nghiệm, giá ống nghiệm.
Tiến hành:
1. Nhận biết từng ion riêng rẽ
Cho vào ống nghiệm (1) khoảng 1 mL dung dịch CaCl2 1 M, ống nghiệm (2) khoảng 1 mL dung dịch BaCl2 1 M, ống nghiệm (3) khoảng 1 mL Na2SO4 1 M.
- Nhỏ từ từ từng giọt dung dịch Na2SO4 1 M vào mỗi ống nghiệm (1) và ống nghiệm (2); nhỏ vài giọt dung dịch BaCl2 1 M vào ống nghiệm (3).
Chú ý: BaCl2 độc, cần tuân thủ quy tắc an toàn trong phòng thí nghiệm.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
2. Ở ống nghiệm (1) và (2), ống nào tạo kết tủa nhanh hơn? Nhiều hơn?
2. Nhận biết ion
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều.
- Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
2. Nêu các hiện tượng xảy ra và giải thích.
Lời giải:
1. Nhận biết từng ion riêng rẽ
1. Phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
Ống nghiệm 1: CaCl2 + Na2SO4 → CaSO4 + 2NaCl.
Ống nghiệm 2: BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
Ống nghiệm 3: Na2SO4 + BaCl2 → BaSO4 + 2NaCl.
2. Ở ống nghiệm (1) và (2), ống nghiệm (2) tạo kết tủa nhanh hơn, nhiều hơn do độ tan tan của BaSO4 là 0,0028 g/100 g nước còn độ tan của CaSO4 là 0,2 g/100 g nước.
2. Nhận biết ion
1. Phương trình hoá học của các phản ứng xảy ra trong thí nghiệm:
Na2CO3(aq) + CaCl2(aq) → CaCO3(s) + 2NaCl(aq)
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
2.
|
Bước tiến hành |
Hiện tượng |
Giải thích |
|
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều. |
Xuất hiện kết tủa trắng. |
Na2CO3 phản ứng với CaCl2 sinh ra chất kết tủa là CaCO3 có màu trắng. Na2CO3(aq) + CaCl2(aq) → CaCO3(s) + 2NaCl(aq) |
|
- Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều. |
Kết tủa tan dần, có khí thoát ra. |
Tiếp tục thêm HCl vào ống nghiệm, HCl phản ứng với CaCO3 tạo thành muối tan là CaCl2 và giải phóng khí CO2. CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l) |
Lời giải Hóa 12 Bài 25: Nguyên tố nhóm IIA hay khác:
Xem thêm lời giải bài tập Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 12 Kết nối tri thức
- Giải SBT Hóa học 12 Kết nối tri thức
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

