Hóa 10 Bài 33: Axit sunfuric - Muối sunfat
Hóa 10 Bài 33: Axit sunfuric - Muối sunfat
Video Giải bài tập Hóa 10 Bài 33: Axit sunfuric - Muối sunfat - Cô Phạm Thu Huyền (Giáo viên VietJack)
Bài 1 (trang 143 SGK Hóa 10 - Video giải tại 22:03): Một hợp chất có thành phần theo khối lượng 35,96% S; 62,92 %O và 1,12 %H. Hợp chất này có công thức hóa học là:
A. H2SO3.
B. H2SO4.
C. H2S2O7.
D. H2S2O8.
Lời giải:
C đúng.
Gọi CT hợp chất là HxSyOz
Ta có x : y : z = 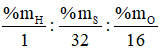
⇒ CT: H2S2O7
Bài 2 (trang 143 SGK Hóa 10 - Video giải tại 24:29): Số oxi hóa của lưu huỳnh trong một loại hợp chất oleum H2S2O7 là:
A. +2.
B. +4.
C. +6.
D. +8.
Lời giải:
C đúng
Gọi số oxi hóa của S là x
Ta có 1.2 + 2.x + 7.(-2) = 0 ⇒ x = 6 ⇒ số oxi hóa của S là +6
Bài 3 (trang 143 SGK Hóa 10 - Video giải tại 25:37): Có 4 lọ, mỗi lọ đựng một dung dịch không màu: NaCl, HCl, Na2SO4, Ba(NO3)2. Hãy nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học xảy ra, nếu có.
Lời giải:
Cho dung dịch BaCl2 vào 4 mẫu thử chứa 4 dung dịch trên, dung dịch trong mẫu thửu nào cho kết tủa trắng là Na2SO4
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Cho dung dịch AgNO3 vào 3 mẫu thử còn lại, dung dịch trong mẫu không cho kết tủa là Ba(NO3)2, còn 2 mẫu thử còn lại cho kết tủa là HCl và NaCl.
HCl + AgNO3 → AgCl↓ + HNO3
NaCl + AgNO3 → AgCl↓ + NaNO3
Để phân biệt dung dịch HCl và NaCl, cho quỳ tím vào 2 dung dịch, dung dịch chuyển màu quỳ tím sang đỏ là HCl, dung dịch không làm chuyển màu quỳ tím là NaCl.
Bài 4 (trang 143 SGK Hóa 10 - Video giải tại 33:05): a) Axit sunfuric đặc được dùng làm khô những khí ẩm, hãy dẫn ra một thí dụ. Có những khí ẩm không được làm khô bằng axit sunfuric đặc, hãy dẫn ra một thí dụ. Vì sao?
b) Axit sunfric đặc có thể biến nhiều hợp chất hữu cơ thành than được gọi là sự hóa than. Dẫn ra những thí dụ về sự hóa than của glocozơ, saccarozơ.
c) Sự làm khô và sự hóa than khác nhau như thế nào?
Lời giải:
a) Axit sunfuric đặc được dùng làm khô những khí ẩm. Thí dụ làm khô khí CO2, không làm khô được khí H2S, H2, ...(do có tính khử).
H2SO4đ + H2 → SO2 + 2H2O
H2SO4đ + 3H2S → 4S + 4H2O
b) Axit sunfuric đặc có thể biến nhiều hợp chất hữu cơ thành than:
C6H12O6 → 6C + 6H2O
C12H22O11 → 12C + 11H2O
c) Sự làm khô: chất được làm khô không thay đổi.
Sự hóa than: chất tiếp xúc với H2SO4 đặc biến thành chất khác trong đó có cacbon.
Bài 5 (trang 143 SGK Hóa 10 - Video giải tại 37:48): a) Trong hợp nào axit sunfuric có nhưng tính chất hóa học chung của một axit ? Đó là những tính chất nào? Dẫn ra những phương trình phản ứng để minh họa.
b) Trong trường hợp nào axit sunfuric có những tính chất hóa học đặc trưng? Đó là những tính chất nào? Dẫn ra những phương trình phản ứng để minh họa.
Lời giải:
a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 → BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
2H2SO4 + 2KBr → Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 → 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng.
Bài 6 (trang 143 SGK Hóa 10 - Video giải tại 42:24): Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
a) Tính thể tích nước cần dung để pha loãng.
b) Khi pha loãng phải tiến hành như thế nào?
Lời giải:
a) Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 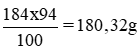
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 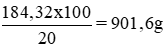
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
b)Cách tiến hành khi pha loãng
Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt..và gây bỏng rất nặng
Xem thêm các bài Giải bài tập Hóa học 10 (có video) hay khác:
- Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- Bài 34: Luyện tập: Oxi và lưu huỳnh
- Bài 35: Bài thực hành số 5. Tính chất các hợp chất của lưu huỳnh
- Bài 36: Tốc độ phản ứng hóa học
- Bài 37: Bài thực hành số 6. Tốc độ phản ứng hóa học
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

