Giáo án Hóa học 8 Bài 42: Nồng độ dung dịch mới nhất (tiết 2)
Giáo án Hóa học 8 Bài 42: Nồng độ dung dịch mới nhất (tiết 2)
Xem thử Giáo án KHTN 8 KNTT Xem thử Giáo án KHTN 8 CTST Xem thử Giáo án KHTN 8 CD
Chỉ từ 500k mua trọn bộ Kế hoạch bài dạy (KHBD) hay Giáo án KHTN 8 cả năm (mỗi bộ sách) bản word chuẩn kiến thức, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. MỤC TIÊU:
1. Kiến thức :
HS nêu được:
- Khái niệm về nồng độ mol (CM).
- Công thức tính CM của dung dịch
2. Kĩ năng :
- Xác định chất tan, dung môi, dung dịch trong một số trường hợp cụ thể.
- Vận dụng được công thức để tính CM của một số dd hoặc các đại lượng có liên quan.
3. Thái độ : Kiên trì trong học tập, cẩn thận trong tính toán.
4. Năng lực cần hướng tới :
- Năng lực tự học
- Năng lực giải quyết vấn đề thông qua môn Hóa học
- Năng lực vận dụng kiến thức hóa học vào cuộc sống
- Năng lực giao tiếp
- Năng lực hợp tác
- Năng lực sử dụng ngôn ngữ Hóa học
- Năng lực tính toán.
II. TRỌNG TÂM:
-Biết cách tính nồng độ % và nồng độ mol của dung dịch
III. CHUẨN BỊ:
1. Giáo viên
Bảng phụ ghi sẵn các bài tập và ghi công thức .
2. Học sinh
Ôn tập bài cũ và chuẩn bị bài mới.
IV. TIẾN TRÌNH BÀI GIẢNG:
1. Ổn định trật tự và kiểm tra bài cũ (5 phút)
Nồng độ % là gì? Nêu công thức tính nồng độ phần trăm, làm bài tập 1/145.
2. Hoạt động dạy học: (30’)
Hoạt động 1: Khởi động – vào bài
Hôm trước chúng ta đã tìm hiểu loại nồng độ phần trăm còn nồng độ mol là gì chúng ta sẽ tìm hiểu trong bài học hôm nay?
Hoạt động 2: Hình thành kiến thức mới
| GIÁO VIÊN | HỌC SINH | NỘI DUNG GHI BẢNG |
|---|---|---|
|
GV: Cung cấp định nghĩa nồng độ mol của dung dịch và công thức tính nồng độ mol. ?Giải thích các đại lượng Bài tập 1 : Trong 250ml dung dịch có hoà tan 0,1mol H2SO4. Tính nồng độ mol của dd? ?Đề bài cho biết gì? ?Yêu cầu làm gì? ?Em có nhận xét gì về đơn vị của thể tích? -Gọi 1 hs đứng tại chỗ tóm tắt đề bài - Viết CT tính nồng độ mol - Để tính nồng độ mol cần tìm những giá trị nào? - Gọi 1 hs lên bảng giải ?Nêu kết luận *Lưu ý: Phải đổi đơn vị của thể tích về lit. Bài tập 2 : Trong 400 ml dung dịch có hoà tan 20 gam NaOH. Tính nồng độ mol của dung dịch bazơ ?Đề bài cho biết gì? ?Yêu cầu làm gì? - Gọi 1 HS lên bảng tóm tắt đề ?Để tính nồng độ mol ta cần biết những đại lượng nào? ?Làm thế nào để có n? Gọi 1 hs lên bảng giải, dưới lớp làm việc theo cá nhân và chấm lấy diểm miệng. Nhận xét, bổ sung. Bài tập 3 : Tìm số mol chất tan có trong 250 ml dung dịch HCl 0,5 M? Bài tập 4 : Tìm thể tích của dung dịch HCl 2M để trong đó có hoà tan 0,5 mol HCl ? -Gọi Hs đọc đề. Chia lớp thành 4 nhóm TL hoàn thành bài hai bài tập 3’ Nhóm 1+2: Bài tập 3 Nhóm 3+4: Bài tập 4 -Gọi đại diện 2 nhóm lên bảng trình bày, còn lại nhận xét. |
-Hs tiếp thu kiến thức CM : nồng độ mol (M) n: số mol (mol) V: thể tích (l) -đọc đề Cho thể tích và số mol của dd. Tính nồng độ mol của dd. -Đổi về đơn vị lit -Tóm tắt: Vdd = 250 ml = 0,25 (l) n = 0,1 (mol) CM của dung dịch = ? (M) -CM = n/V -Cần phải biết n và V Áp dụng công thức CM = n/ V = 0,1 / 0,25 =0,4 (M) -Thể tích dung dịch, khối lượng chất tan NaOH. -Tính nồng độ mol -Tóm tắt: Vdd = 400 (ml) = 0,4 (l) mNaOH = 20(g) CM = ? (M) -n, V. Áp dụng công thức n = m/M - Nhận xét, bổ sung (nếu có) -Đọc đề Thảo luận nhóm 3’ -Đại diện 2 nhóm lên bảng trình bày. |
II. Nồng độ mol của dung dịch. 1.Định nghĩa : Nồng độ mol (CM) của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch . *Công thức: CM : nồng độ mol (M) n: số mol (mol) V: thể tích (l) 2. Bài tập vận dụng. Bài tập 1 : Vdd = 250ml=0,25 (l) Áp dụng công thức Vậy nồng độ mol của dung dịch trên là 0,4(M) Bài tập 2 : Vdd = 0,4 (l) Số mol NaOH có trong dd là : Nồng độ mol của dung dịch là Vậy nồng độ mol của dung dịch thu được là 1,25 (M). Bài tập 3 : Vdd = 0,25 (l) Số mol chất tan có trong dd là: n = V. CM n = 0,25. 0,5 n = 1,25 mol Bài tập 4 : Thể tích của dung dịch là : Vậy, thể tích của dung dịch thu được là 250 (ml) |
Hoạt động 3: Luyện tập, vận dụng (5 phút)
Giáo viên hệ thống kiến thức và hướng dẫn HS hoàn thành các bài tập sau:
-Câu 1 : Tìm khối lượng của chất tan trong 50ml dung dịch NaCl 0,1mol ?
Hướng dẫn:
Công thức tính khối lượng: m = n . M
→ Để tính khối lượng cần tìm: n và M
Trong đó, số mol : n = V.CM
-Câu 2 : Trộn 2 lít dung dịch đường 0,5 M với 3 lít dung dịch đường 1M. Tính nồng độ mol của dung dịch đường sau khi trộn
Hướng dẫn:
Bước 1: Tìm số mol chất tan có trong mỗi mol dung dịch ( n1 và n2)
n1 = 0,5.2 = 1 (mol)
n2 = 1.3 = 3 (mol )
Bước 2: Tìm tổng thể tích của 2 dung dịch
( V1 + V2 )= V= 2 + 3 = 5 (lít )
Bước 3: Tính nồng độ mol của hỗn hợp:
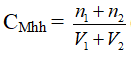
Hoạt động 4: Tìm tòi – mở rộng (5 phút)
GV nhắc HS:
- Học bài giảng và làm BTVN: 2,3,4,6 sgk trang 146
- Chuẩn bị trước bài 43 phần 1
V. RÚT KINH NGHIỆM
............................................................................................................................................................
............................................................................................................................................................
............................................................................................................................................................
Xem thử Giáo án KHTN 8 KNTT Xem thử Giáo án KHTN 8 CTST Xem thử Giáo án KHTN 8 CD
Xem thêm các bài soạn Giáo án Hóa học lớp 8 theo hướng phát triển năng lực mới nhất, hay khác:
- Giáo án Hóa học 8 Bài 42: Nồng độ dung dịch
- Giáo án Hóa học 8 Bài 43: Pha chế dung dịch
- Giáo án Hóa học 8 Bài 43: Pha chế dung dịch (Tiết 2)
- Giáo án Hóa học 8 Bài 44: Bài luyện tập 8
- Giáo án Hóa học 8 Bài 45: Bài thực hành 7
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giáo án Hóa học lớp 8 mới, chuẩn nhất của chúng tôi được biên soạn bám sát nội dung sgk Hóa học 8 theo chuẩn Giáo án của Bộ GD & ĐT.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 8 (các môn học)
- Giáo án điện tử lớp 8 (các môn học)
- Giáo án Toán 8
- Giáo án Ngữ văn 8
- Giáo án Tiếng Anh 8
- Giáo án Khoa học tự nhiên 8
- Giáo án KHTN 8
- Giáo án Lịch Sử 8
- Giáo án Địa Lí 8
- Giáo án GDCD 8
- Giáo án HĐTN 8
- Giáo án Tin học 8
- Giáo án Công nghệ 8
- Giáo án Vật Lí 8
- Giáo án Hóa học 8
- Giáo án Sinh học 8
- Đề thi lớp 8 (các môn học)
- Đề thi Ngữ Văn 8 (có đáp án)
- Chuyên đề Tiếng Việt lớp 8
- Đề thi Toán 8
- Đề cương ôn tập Toán 8
- Đề thi Tiếng Anh 8 (có đáp án)
- Đề thi Tiếng Anh 8 mới (có đáp án)
- Đề thi Khoa học tự nhiên 8 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 8 (có đáp án)
- Đề thi GDCD 8 (có đáp án)
- Đề thi Tin học 8 (có đáp án)
- Đề thi Công nghệ 8 (có đáp án)

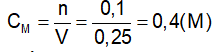
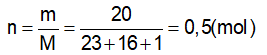
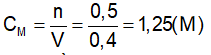
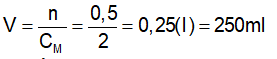



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

