Công thức Lewis của CCl3
Bài viết hướng dẫn cách viết Công thức Lewis của CCl3 theo chương trình sách mới Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Công thức Lewis của CCl3.
Công thức Lewis của CCl3
1. Viết công thức Lewis của CCl3 dựa vào công thức electron
Sự hình thành phân tử CCl3:
Nguyên tử Cl có 7 electron hóa trị, cần thêm 1 electron nữa để đạt octet.Nguyên tử C có 4 electron hóa trị, cần 4 electron để đạt octet.
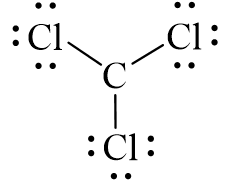
Trong phân tử CCl3, mỗi nguyên tử Cl góp chung 1 electron với nguyên tử C cạnh nó tạo thành 1 cặp electron dùng chung. Khi đó các nguyên tử Cl đã đạt octet.Nguyên tử C chưa đạt octet vì còn 1 electron hóa trị tự do.
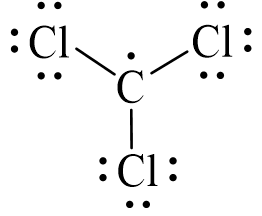
Công thức electron của CCl3 là:
Từ công thức electron của CCl3, thay mỗi cặp electron dùng chung bằng một gạch nối. Ta được công thức Lewis của CCl3 là:
2. Viết công thức Lewis dựa theo công thức phân tử và electron hoá trị
Tiến hành theo các bước sau:
Bước 1: Tính tổng số electron hóa trị trong phân tử
C có 4 electron hóa trị, Cl có 7 electron hóa trị. Trong phân tử CCl3, có 1 nguyên tử C và 3 nguyên tử Cl.
Vậy tổng số electron hóa trị = 4.1 + 7.3 = 25 electron.
Bước 2. Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
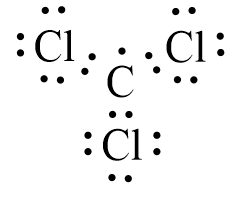
Trong phân tử CCl3, nguyên tử C là nguyên tử trung tâm, các nguyên tử Cl được xếp xung quanh như sau:
Bước 3. Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
25 – 2.3 = 19 electron.
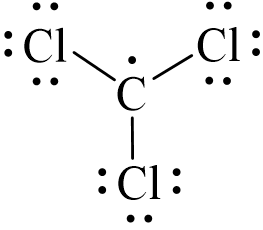
Sử dụng 18 electron để tạo octet cho ba nguyên tử Cl.
Đã sử dụng hết 18 electron để tạo octet cho 3 nguyên tử Cl. Nguyên tử C còn lại nhận 1 electron tự do vì không góp chung với nguyên tử nào khác.
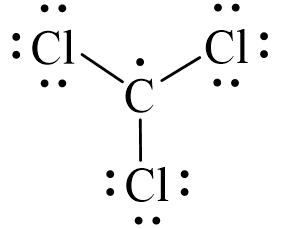
Vậy công thức Lewis của CCl3 là
3. Lưu ý
Trong một số trường hợp công thức Lewis, nguyên tử trung tâm có thể có số lẻ electron, hoặc nhiều hơn 8 electron, hoặc ít hơn 8 electron.
4. Ví dụ minh họa
Câu 1. Số electron chưa tham gia liên kết trong trong phân tử CCl3 là
A. 19.
B. 25.
C. 13.
D. 18.
Hướng dẫn giải
Đáp án đúng: A
Xem thêm cách viết công thức Lewis của một số chất hay, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



