Công thức Lewis của ClF3
Bài viết hướng dẫn cách viết Công thức Lewis của ClF3 theo chương trình sách mới Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Công thức Lewis của ClF3.
Công thức Lewis của ClF3
1. Viết công thức Lewis của ClF3 dựa vào công thức electron
Sự hình thành phân tử ClF3:
Nguyên tử F có 7 electron hóa trị, cần thêm 1 electron nữa để đạt octet.Nguyên tử Cl có 7 electron hóa trị, cần 1 electron để đạt octet.
Trong phân tử ClF3, mỗi nguyên tử F góp chung 1 electron với nguyên tử Clcạnh nó tạo thành 1 cặp electron dùng chung. Khi đó các nguyên tử F đã đạt octet.Tuy nhiên nguyên tử Cl không thể đạt octet vì sau khi tạo liên kết đạt được 10 electron lớp ngoài cùng.
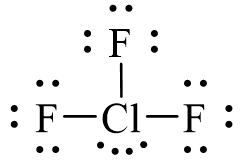
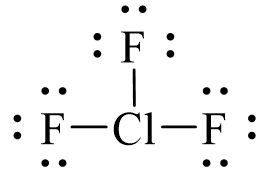
Công thức electron của ClF3 là:
Từ công thức electron của ClF3, thay mỗi cặp electron góp chung bằng một gạch nối. Ta được công thức Lewis của ClF3 là:
2. Viết công thức Lewis dựa theo công thức phân tử và electron hoá trị
Tiến hành theo các bước sau:
Bước 1: Tính tổng số electron hóa trị trong phân tử
Cl có 7 electron hóa trị, F có 7 electron hóa trị. Trong phân tử ClF3, có 1 nguyên tử Cl và 3 nguyên tử F.
Vậy tổng số electron hóa trị = 7.1 + 7.3 = 28 electron.
Bước 2. Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
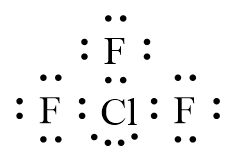
Trong phân tử ClF3, nguyên tử Cl là nguyên tử trung tâm, các nguyên tử F được xếp xung quanh như sau:
Bước 3. Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
28 – 2.3 = 22 electron.
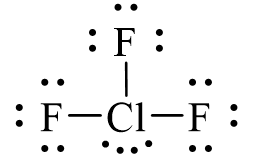
Sử dụng 18 electron để tạo octet cho 3 nguyên tử F.
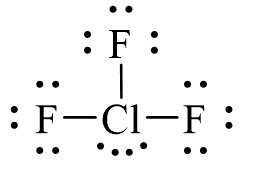
Đã sử dụng hết 18 electron để tạo octet cho 3 nguyên tử F. Còn lại 4 electron hóa trị sẽ đặt vào nguyên tử trung tâm Cl.
Vậy công thức Lewis của ClF3 là
3. Lưu ý
Trong một số trường hợp công thức Lewis, nguyên tử trung tâm có thể có số lẻ electron, hoặc nhiều hơn 8 electron, hoặc ít hơn 8 electron.
4. Ví dụ minh họa
Câu 1. Liên kết giữa nguyên tử Cl và nguyên tử F là loại liên kết gì?
A. Liên kết hydrogen.
B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực.
D. Liên kết ion.
Hướng dẫn giải
Đáp án đúng là: B
Xem thêm cách viết công thức Lewis của một số chất hay, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



