Top 9 Đề thi Hóa học 8 Chương 5 có đáp án, cực hay
Top 9 Đề thi Hóa học 8 Chương 5 có đáp án, cực hay
Dưới đây là danh sách Top 9 Đề thi Hóa học 8 Chương 5 có đáp án, cực hay gồm các đề kiểm tra 15 phút, 1 tiết. Hi vọng bộ đề thi này sẽ giúp bạn ôn tập & đạt điểm cao trong các bài thi Hóa học 8.
Đề kiểm tra 15 phút
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 1)
Câu 1: Viết phương trình hoá học của các phản ứng hidro khử các oxit sau:
a) Sắt(III) oxit
b) Thuỷ ngân(II) oxit
c) Chì(II) oxit
Câu 2: Khử 48 gam đồng (II) oxit bằng khí hidro. Hãy:
a) Tính số gam đồng kim loại thu được.
b) Tính thể tích khí hidro (đktc) cần dùng.
Đáp án và hướng dẫn giải
Câu 1: Phương trình hoá học:
Fe2O3 + 3H2 −to→ 2Fe + 3H2O
HgO + H2 −to→ Hg + H2O
PbO + H2 −to→ Pb + H2O
Câu 2: Phản ứng: CuO + H2 −to→ Cu + H2O (1)
Ta có: nCuO = mCuO/MCuO = 48/(64+16) = 0,6 (mol)
Từ (1) → nCu = 0,6 (mol)
→ mCu = nCu x MCu = 0,6 x 64 = 38,4 (gam).
b) Từ (1) → nH2= 0,6 (mol)
→ VH2= 22,4 x nH2= 22,4 x 0,6 = 13,44 (lít).
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 2)
Câu 1 : Tính thể tích khí hidro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra 1,8 gam nước.
Câu 2 : Có ba lọ riêng biệt đựng các chất khí sau : oxi, hidro, nitơ. Trình bày phương pháp hoá học để phân biệt từng khí riêng biệt.
Đáp án và hướng dẫn giải
Câu 1 : Phương trình hoá học :
2H2 + O2 −to→ 2H2O
(mol) 0,1 ← 0,05 ← 0,1
Ta có : nH2O= 1,8/18= 0,1 (mol)
Vậy : nO2= 0,05 (mol) → VO2= 22,4 x nO2 = 22,4 x 0,05 = 1,12 (lít)
nH2= 0,1 (mol) → VH2= 22,4 x 0,1 = 2,24 (lít).
Câu 2 :
- Cho vào mỗi lọ đựng khí một que đóm còn tàn đỏ. Ở lọ nào que đóm bùng cháy là lọ chứa khí oxi. Hai lọ còn lại que đóm tắt.
- Tiếp tục dẫn khí ở hai lọ còn lại qua chứa CuO, nung nóng:
+ Ống nghiệm nào bột CuO màu đen chuyển dần thành lớp kim loại màu đỏ gạch thì khí dẫn qua CuO là H2.
CuO(đen) + H2 → Cu(đỏ) + H2O
+ Ống nghiệm còn lại không có hiện tượng gì thì khí dẫn qua là N2.
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 3)
Câu 1: Hãy cho biết trong những phản ứng oxi hoá học xảy ra quanh ta sau đây, phản ứng nào là phản ứng oxi hoá – khử? Lợi ích và tác hại của mỗi phản ứng?
Đốt than trong lò: C + O2 −to→ CO2
Dùng cacbon oxit khử sắt (III) oxit trong luyên kim:
Fe2O3 + 3CO −to→ 2Fe + 3CO2
Nung vôi: CaCO3 −to→ CaO + CO2
Sắt bị gỉ trong không khí:
4Fe + 3O2 −to→2Fe2O3.
Câu 2: Trong phòng thí nghiệm, người ta dùng hidro để khử sắt (III) oxit và thu được 11,2 gam sắt.
Viết phương trình hoá học của phản ứng đã xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hidro đã tiêu thụ (ở đktc).
Đáp án và hướng dẫn giải
Câu 1: Phản ứng oxi hoá – khử: đốt than trong lò, dùng cacbon oxit khử sắt(III) oxit trong luyện kim, sắt bị gỉ trong không khí.
Phản ứng a có lợi: sinh ra nhiệt để sản xuất, phục vụ đời sống; tác hại: tạo ra khí CO2 làm ô nhiễm môi trường.
Phản ứng b có lợi: luyện quặng sắt thành sắt, điều chế sắt; tác hại: sinh ra khí CO2 làm ô nhiễm môi trường.
Phản ứng d có hại: làm sắt bị gỉ dẫn đến hư hại các công trình xây dựng, các dụng cụ và đồ dùng bằng sắt.
Câu 2:
Phương trình hoá học:
3H2 + Fe2O3 −to→ 2Fe + 3H2O (1)
0,3 0,1 ← 0,2 (mol)
Ta có: nFe = 11,2/56 = 0,2 (mol).
Từ (1) → nFe2O3 = 0,1 (mol) → mFe2O3 = 0,1 x 160 = 16 (gam)
Từ (1) → nH2= 0,3 (mol)
→ VH2= 22,4 x nH2= 22,4 x 0,3 = 6,72 (lít).
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 4)
Câu 1: Thế nào là phản ứng oxi hoá – khử? Lấy ví dụ minh hoạ.
Câu 2: Trong phòng thí nghiệm, người ta đã dùng cacbon oxit CO để khử 0,2 mol Fe3O4 và dùng khí hidro để khử 0,2 mol Fe2O3 ở nhiệt độ cao.
a) Viết phương trình hoá học của các phản ứng đã xảy ra.
b) Tính số lít khí CO và H2 ở đktc cần dùng cho mỗi phản ứng.
c) Tính số gam sắt thu được ở mỗi phản ứng hoá học.
Đáp án và hướng dẫn giải
Câu 1: Phản ứng oxi hoá – khử là phản ứng hoá học trong đó có xảy ra đồng thời sự oxi hoá và sự khử.
Ví dụ: Fe2O3 + 3H2 −to→ 2Fe + 3H2O
CuO + H2 −to→ Cu + H2O
Câu 2:
Phương trình hoá học:
Fe3O4 + 4CO −to→ 3Fe + 4CO2 (1)
Fe2O3 + 3H2 −to→ 2Fe + 3H2O (2)
Từ (1) → nCO = 0,8 (mol)
→ VCO = 22,4 x nCO = 22,4 x 0,8 = 17,92 (lít)
Và nH2= 0,6 (mol) → VH2= 22,4 x nH2 = 22,4 x 0,6 = 13,44 (lít).
Từ (1) → nFe/(1) = 0,6 (mol) → mFe/(1) = 0,6 x 56 = 33,6 (gam).
Từ (2) → nFe/(2) = 0,4 (mol) → mFe/(2) = 0,4 x 56 = 22,4 (gam).
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 5)
Câu 1: Những phản ứng hoá học nào dưới đây có thể được dùng để điều chế hidro trong phòng thí nghiệm?
a) Zn + H2SO4 (loãng) → ZnSO4 + H2
b) 2H2O −điện phân→ 2H2↑ + O2↑
c) 2Al + 6HCl → 2AlCl3 + 3H2↑
Câu 2: Cho từ từ 3,25 gam kẽm viên vào 120 ml dung dịch HCl 1M. Xác định thể tích khí hidro sinh ra ở đktc.
Đáp án và hướng dẫn giải
Câu 1: Phản ứng dùng để điều chế hidro trong phòng thí nghiệm là a, c.
Câu 2: Ta có: nZn = 3,25/65 = 0,05 (mol); nHCl = 0,12 x 1 = 0,12 (mol)
Zn + 2HCl → ZnCl2 + H2 ↑ (1)
0,05 0,12 mol
Vậy sau phản ứng HCl dư nên Số mol H2 tính theo số mol Zn
Từ (1) => nH2= nZn = 0,05 (mol) => VH2= 0,05 x 22,4 = 1,12 (lít).
Đề kiểm tra 1 tiết
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 1)
Câu 1: Hoàn thành các phương trình phản ứng sau:
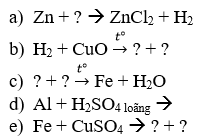
Câu 2: Hãy xác định chất oxi hóa, chất khử, sự oxi hóa và sự khử trong phản ứng oxi hóa – khử sau:
H2 + HgO −to→ Hg + H2O
Câu 3: Có 3 lọ đựng riêng biệt các khí sau: oxi, không khí và hiđro. Bằng thí nghiệm nào có thể nhận ra các khí trong mỗi lọ?
Câu 4: Lập phương trình hóa học cho các phản ứng sau:
Cacbon đioxit + nước →axit cacbonic (H2CO3)
Lưu huỳnh đioxit + nước → axit sunfurơ (H2SO3)
Sắt + axit clohidric → sắt clorua + H2↑
Điphotpho pentaoxit + nước → axit photphoric (H3PO4)
Chì(II) oxit + hiđro→chì (Pb) + nước
Câu 5: Trong phòng thí nghiệm, người ta dùng hiđro để khử sắt(III) oxit và thu được 11,2 gam sắt.
Viết phản ứng hóa học xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hiđro đã tiêu thụ (đktc).
Đáp án và hướng dẫn giải
Câu 1:Hoàn thành các phương trình phản ứng:
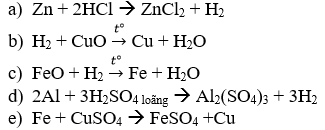
Câu 2:
H2 là chất khử vì là chất chiếm oxi
HgO là chất oxi hóa vì là chất nhường oxi.
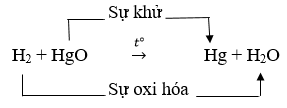
Câu 3: Đưa que đóm còn tàn đóm đỏ vào 3 bình khí trên. Bình khí làm que đóm bùng cháy là oxi.
Đốt 2 khí còn lại. Khi cháy với ngọn lửa màu xanh nhạt là H2, còn lại là không khí.
2H2 + O2 → 2H2O
Câu 4: Lập phương trình các phản ứng:
Cacbon đioxit + nước → axit cacbonic (H2CO3)
CO2 + H2O → H2CO3
Lưu huỳnh đioxit + nước → axit sunfurơ (H2SO3)
SO2 + H2O →H2SO3
Sắt + axit clohiđric → sắt clorua + H2 ↑
Fe + 2HCl → FeCl2 + H2
Điphotpho pentaoxit + nước → axit photphoric (H3PO4)
P2O5 + 3H2O → 2H3PO4
Chì(II) oxit + hiđro → chì (Pb) + nước
PbO + H2 −to→ Pb + H2O
Câu 5:
Phương trình hóa học:
Fe2O3 + 3H2 −to→ 2Fe + 3H2O (1)
(mol) 0,1 0,3 ← 0,2
Ta có: nFe = 11,2/56 = 0,2 (mol)
Từ (1) → nFe2O3= 0,1 (mol) → mFe2O3= 0,1 x 160 = 16 (gam)
Từ (1) → nH2= 0,3 (mol)
→ VH2= 0,3 x 22,4 = 6,72 (lít)
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 2)
Câu 1: Cho các phương trình hóa học sau:
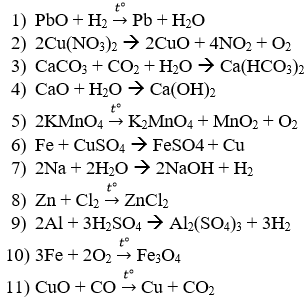
Phản ứng nào là hóa hợp; phân hủy; thế; oxi hóa – khử?
Câu 2: Cho từ từ 3,25 gam kẽm viên vào 120ml dung dịch HCl 1M. Xác định thể tích khí hiđro sinh ra (ở đktc).
Câu 3: Để hòa tan hoàn toàn 7,2 gam một kim loại M hóa trị II thì cần dùng hết 200ml dung dịch axit HCl 3M. Xác định tên kim loại M đem dùng.
Câu 4: Dùng khí hiđro để khử các oxit sau thành kim loại: FeO, Fe2O3, Fe3O4, Cu2O. Nếu lấy cùng số mol mỗi oxit thì tỉ lệ số mol khí hiđro đối với số mol kim loại sinh ra của oxit nào là lớn nhất?
Đáp án và hướng dẫn giải
Câu 1: Phản ứng hóa hợp là: 3, 4, 8, 10.
Phản ứng phân hủy là: 2, 5.
Phản ứng thế là: 6, 7, 9.
Phản ứng oxi hóa – khử là: 1, 2,5, 6, 7, 8, 9, 10, 11.
Câu 2: Ta có: nZn = 3,25/65 = 0,05 (mol); nHCl = 0,12 x 1 = 0,12 (mol)
Zn + 2HCl → ZnCl2 + H2↑ (1)
Từ phản ứng (1), ta thấy số mol axit dư nên tính số mol khí hiđro sinh ra theo Zn.
nH2= nZn= 0,05 (mol) → VH2= 0,05 x 22,4 = 1,12 (lít).
Câu 3: Phản ứng: M + 2HCl → MCl2 + H2↑ (1)
Theo (1) → nM = 1/2 nHCl = 1/2 x 0,2 x 3 = 0,3 (mol)
Nguyên tử khối của M là 7,2/0,3 = 24: magie (Mg).
Câu 4: Phản ứng:
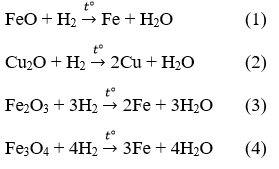
Đặt số mol của mỗi oxit là a mol.
Từ (3) → nH2: nFe = 3a/2a = 1,5 là lớn nhất so vối 3 phản ứng còn lại.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 3)
Câu 1: Để điều chế khí hiđro trong phòng thí nghiệm, người ta có thể dùng kim loại kẽm, magie, nhôm cho tác dụng với axit clohiđric hoặc axit sunfuric loãng. Nếu lượng khí hiđro sinh ra bằng nhau trong mỗi trường hợp thì dùng kim loại nào phản ứng với axit nào sẽ có khối lượng chất tham gia phản ứng nhỏ nhất?
Câu 2: Hòa tan hoàn toàn 44,8 lít khí SO2 (đktc) vào nước dư, người ta thu được dung dịch axit sunfurơ. Cho vào dung dịch này một lượng dư muối BaCl2. Tính khối lượng kết tủa tạo thành.
Câu 3: Dùng khí hiđro dư để khử x gam sắt(III) oxit, sau phản ứng người ta thu được y gam sắt kim loại. Nếu dùng lượng sắt này cho phản ứng hoàn toàn với axit clohiđric có dư thì thu được 5,6 lít khí hiđro đo ở điều kiện tiêu chuẩn.
a) Viết các phương trình phản ứng hóa học.
b) Hãy xác định giá trị x, y và lượng muối sắt(II) clorua tạo thành sau phản ứng.
Câu 4: Dùng khí hiđro để khử hoàn toàn 6 gam một oxit sắt thì thu được 4,2 gam Fe. Tìm công thức phân tử của oxit sắt.
Đáp án và hướng dẫn giải
Câu 1:
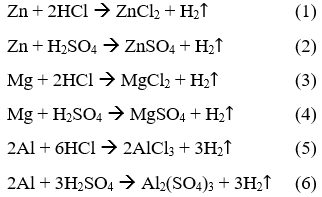
Đặt số mol hiđro sinh ra là a, ta dễ dàng tính được số mol của từng kim loại và của từng axit. Từ đó tính ra khối lượng của chúng và sẽ thấy được chỉ ở phản ứng (5) khối lượng Al và khối lượng HCl là nhỏ nhất.
Câu 2: Phản ứng: SO2 + H2O H2SO3 (1)
H2SO3 + BaCl2 → BaSO3↓ + 2HCl (2)
Từ (1) và (2) suy ra: nBaSO3= nSO2= 44,8/22,4 = 2 (mol)
→ mBaSO3= 2 x 217 = 434 (gam).
Câu 3:
Các phương trình phản ứng hóa học:
Fe2O3 + 3H2 −to→ 2Fe + 3H2O (1)
Fe + 2Hcl → FeCl2 + H2 (2)
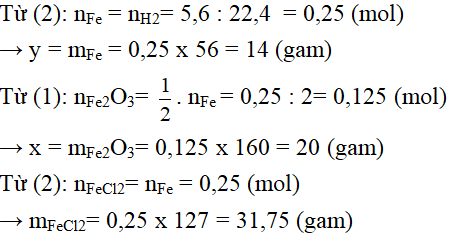
Câu 4: Đặt công thức phân tử của oxit sắt là FexOy (sắt có hóa trị 2x/y)
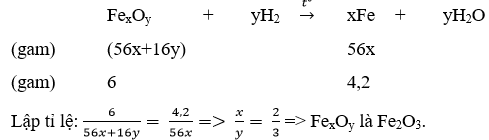
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 4)
Câu 1: Cho 2,8 gam sắt tác dụng với dung dịch axit sunfuric loãng. Sau phản ứng dẫn hết khí đi qua 4,8 gam bột đồng (II) oxit đun nóng. Tính khối lượng hỗn hợp rắn thu được.
Câu 2: Khử 48 gam đồng(II) oxit bằng khí hiđro. Hãy:
a) Tính khối lượng đồng thu được.
b) Tính thể tích khí hiđro (đktc) cần dùng.
Câu 3: Cho 22,4 gam sắt tác dụng với dung dịch loãng có chứa 24,5 gam axit sunfuric.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí hiđro thu được ở đktc.
Câu 4: Viết phương trình hóa học theo các dãy biến hóa sau:
a) Na →Na2O → NaOH →Na2SO4
b) Ca →CaO →Ca(OH)2 → CaCO3 → Ca(HCO3)2
Đáp án và hướng dẫn giải
Câu 1: Ta có: nFe = 2,8/56 = 0,05 (mol); nCuO = 4,8/80 = 0,06 (mol)
Phản ứng: Fe + H2SO4 → FeSO4 + H2↑ (1)
(mol) 0,05 → 0,05
H2 + CuO −to→ Cu + H2O (2)
(mol) 0,05 → 0,05 0,05
Từ (2) → Khối lượng chất rắn thu được sau phản ứng gồm:
Cu (0,05 mol) và nCuO dư = 0,06 – 0,05 = 0,01 (mol)
Vậy: mCu = 0,05 x 64 = 3,2 (gam)
Và mCuO dư = 0,01 x 80 = 8 (gam)
Câu 2: Ta có: nCuO = 48/80 = 0,6 (mol)
Phản ứng: CuO + H2 −to→ Cu + H2O (1)
(mol) 0,6 → 0,6 0,6
Từ (1) → nCu = 0,6 (mol) → mCu = 0,6 x 64 = 38,4 (gam)
Từ (1) → nH2= 0,6 (mol) → VH2= 0,6 x 22,4 = 13,44 (lít)
Câu 3:
Ta có: nFe= 22,4/56 = 0,4 (mol) và nH2SO4= 24,5/98 = 0,25 (mol)
Phản ứng:
Fe + H2SO4 → FeSO4 + H2↑ (1)
(mol) 0,25 ← 0,25 → 0,25 0,25
Vì nFe : nH2SO4= 1 : 1 và nFe > nH2SO4
Sau phản ứng (1) thì sắt dư.
nFe dư = 0,4 - 0,25 = 0,15 (mol) → mFe dư = 0,15 x 56 =8,4 (g)
Từ (1) → nH2 = 0,25 (mol) → VH2= 0,25 x 22,4 = 5,6 (lít)
Câu 4:
4Na + O2 → 2Na2O
Na2O + H2O →2NaOH
2NaOH + H2SO4 → Na2SO4 + H2O
2Ca + O2 → 2CaO
CaO + H2O → Ca(OH)2
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3 + H2O + CO2 → Ca(HCO3)2
Xem thêm các đề kiểm tra, đề thi Hóa học lớp 8 chọn lọc, có đáp án hay khác:
- Chương 1: Chất - Nguyên tử - Phân tử
- Chương 2: Phản ứng hóa học
- Chương 3: Mol và tính toán hóa học
- Chương 4: Oxi - Không khí
- Chương 6: Dung dịch
Tổng hợp Bộ đề thi Hóa học lớp 8 năm 2025 học kì 1 và học kì 2 có đáp án của chúng tôi được biên soạn và sưu tầm từ đề thi môn Hóa học của các trường THCS trên cả nước.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều

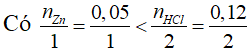

 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



