150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (cơ bản – phần 2)
Với 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Crom, Sắt, Đồng.
150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (cơ bản – phần 2)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài tập tổng hợp về sắt và hợp chất của sắt - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Câu 41. X là một hợp chất của Zn thường được dùng trong y học, với tác dụng làm thuốc giảm đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,.... Chất X là
A. Zn(NO3)2 B. ZnSO4
C. ZnO D. Zn(OH)2
Lời giải:
ZnO được dùng trong y học, với tác dụng làm thuốc đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,..do ZnO có tính chất làm săn da, sát khuẩn, bảo vệ, làm dịu tổn thương da,..
→ Đáp án C
Câu 42. Thêm bột sắt (dư) vào các dung dịch riêng biệt sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HCl, HNO3 (loãng), H2SO4 (đặc nóng). Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp phản ứng tạo ra muối Fe(II) là
A. 4. B. 5.
C. 6. D. 7.
Lời giải:
Nhúng 1 lá sắt nhỏ vào dung dịch chứa 1 trong các chất sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HCl, HNO3, H2SO4 (đặc, nóng), NH4NO3.
• Fe + 2FeCl3 → 3FeCl2
• Fe + AlCl3 → không phản ứng.
• Fe + CuSO4 → FeSO4 + Cu↓
• Fe + Pb(NO3)2 → Fe(NO3)2 + Pb↓
• Fe + 2HCl → FeCl2 + H2
• Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe dư + 2Fe(NO3)3 → 3Fe(NO3)2
• 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Fe dư + Fe2(SO4)3 → 3FeSO4
→ Số trường hợp tạo muối Fe(II) là 6
→ Đáp án C
Câu 43. Cho các ion kim loại: Zn2+, Sn2+, Ni2+, Fe2+, Pb2+. Thứ tự tính oxi hoá giảm dần là
A. Pb2+ > Sn2+ > Fe2+ > Ni2+ > Zn2+.
B. Sn2+ > Ni2+ > Zn2+ > Pb2+ > Fe2+.
C. Zn2+ > Sn2+ > Ni2+ > Fe2+ > Pb2+.
D. Pb2+ > Sn2+ > Ni2+ > Fe2+ > Zn2+.
Lời giải:
Thứ tự tính khử tăng dần: Pb < Sn < Ni < Fe < Zn
Nên tính oxi giảm dần: Pb2+ > Sn2+ > Ni2+ > Fe2+ > Zn2+
→ Đáp án D
Câu 44. Cho các phát biểu sau:
(a) Các kim loại kiềm đều tan tốt trong nước.
(b) Các kim loại Mg, Fe, K và Al chỉ điều chế được bằng phương pháp điện phân nóng chảy.
(c) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(d) Khi cho Mg vào dung dịch FeCl3 dư thu được kim loại Fe.
Số phát biểu đúng là:
A. 2. B. 4.
C. 1. D. 3.
Lời giải:
(a) đúng
(b) sai do Fe không phải chỉ điều chế được bằng phương pháp điện phân nóng chảy
(c) sai do K khi cho vào dung dịch sẽ phản ứng với H2O trước nên sẽ không thể khử được Ag+
(d) sai, khi cho Mg vào Fe3+ thì sẽ phản ứng theo quy tắc alpha (tạo Fe2+), do đó, khi Fe3+ đang dư thì sẽ không tạo được Fe
Như vậy, chỉ có 1 phát biểu đúng
→ Đáp án C
Câu 45. Tôn lợp nhà thường là hợp kim nào dưới đây ?
A. Sắt tráng kẽm
B. Sắt tráng thiếc
C. Sắt tráng magie
D. Sắt tráng niken
Lời giải:
Tôn lợp nhà thường là hợp kim sắt tráng kẽm, một số mạ nhôm kẽm,..để kháng nhiệt, chống ăn mòn, mang tính thẩm mỹ
→ Đáp án A
Câu 46. Cho hỗn hợp gồm a mol FeS2 và b mol Cu2S tác dụng vừa đủ với dung dịch HNO3 thì thu được dung dịch A (chứa 2 muối sunfat) và 0,8 mol khí NO là sản phẩm khử duy nhất. Tìm a và b là
A. a = 0,06; b = 0,03.
B. a = 0,12; b = 0,06.
C. a = 0,06; b = 0,12.
D. a = 0,03; b = 0,06.
Lời giải:
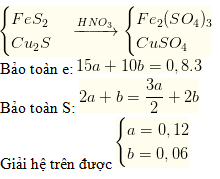
Câu 47. Các số oxi hoá có thể có của bạc trong hợp chất là
A. +1. B. +2.
C. +3. D. Cả 3 đều đúng.
Lời giải:
Trong các hợp chất, bạc có số oxi hóa phổ biến là +1, ngoài ra bạc còn có số oxi hóa là +2, +3
→ Đáp án D
Câu 48. Cho các phản ứng:
(1) Fe3O4 + H2SO4(loãng) → FeSO4 + Fe2(SO4)3 + H2O
(2) Fe + H2O → FeO + H2
(3) Fe(NO3)2 + HCl → FeCl3 + NO + H2O
(4) FeS + H2SO4(đặc nóng) → Fe2(SO4)3 + H2S + H2O
Có bao nhiêu phản ứng viết đúng ?
A. 1. B. 2.
C. 3. D. 4.
Lời giải:
(1) Đúng
(2) Đúng. Ở nhiệt độ dưới 570oC, sản phẩm Fe cộng nước là Fe3O4
(3) Sai. 9Fe(NO3)2 + 12HCl → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
(4). Sai. FeS + H2SO4đn → Fe2(SO4)3 + SO2 + H2O
→ Đáp án B
Câu 49. Cho một miếng Fe vào cốc đựng H2SO4 loãng. Bọt khí H2 sẽ bay ra nhanh hơn khi thêm vào cốc trên dung dịch nào trong các dung dịch sau:
A. HgSO4 B. Na2SO4
C. Al2(SO4)3 D. MgSO4
Lời giải:
- Ban đầu, Fe tiếp xúc trực tiếp với ion H+ của axit, sắt bị ăn mòn hóa học theo phản ứng:
Fe + 2H+ → Fe2+ + H2↑
- Khi H2 sinh ra bám vào bề mặt là sắt, ngăn cản tiếp xúc giữa Fe và H+, giảm tốc độ phản ứng.
- Khi thêm vài giọt HgSO4 vào, vì tính oxi hóa Hg2+ vào, vì tính oxi hóa Hg2+ > H+, nên có phản ứng: Fe + 2Hg2+ → Fe2+ + Hg.
- Hg tạo ra bám vào Fe tạo thành hai điện cực (pin điện) và Fe bị ăn mòn điện hóa, vì tính khử Fe > Hg: Cực âm (Fe): Fe → Fe2+ + 2e, Cực dương (Hg): 2H+ + 2e → H2↑
Khí thoát ra ở cực Hg, nên Fe bị ăn mòn nhanh hơn
→ Đáp án A
Câu 50. Cho sơ đồ chuyển hóa quặng đồng thành đồng:
CuFeS2 -+O2, to→ X -+O2, to→ Y -+X, to→ Cu.
Hai chất X, Y lần lượt là:
A. Cu2O, CuO B. CuS, CuO
C. Cu2S, CuO D. Cu2S, Cu2O
Lời giải:
2CuFeS2 + 4O2 -to→ Cu2S (X) + 2FeO + 3SO2
2Cu2S + O2 → 2Cu2O (Y) + 2SO2
2Cu2O + Cu2S → 6Cu + SO2
⇒ Hai chất X, Y lần lượt là Cu2S và Cu2O.
→ Đáp án D
Câu 51. Sắt tây thường được dùng làm vỏ đồ hộp đựng thực phẩm. Hãy cho biết sắt tây là sắt được phủ bởi kim loại nào ?
A. Zn B. Sn
C. Al D. Ni
Lời giải:
Sắt tây được dùng làm vỏ đồ hộp đựng thực phẩm là sắt được tráng Sn có tác dụng chống ăn mòn, tạo vẻ đẹp và không độc hại.
→ Đáp án B
Câu 52. Hiện tượng gì xảy ra khi nhỏ một ít dung dịch KMnO4 vào dung dịch có chứa FeSO4 và H2SO4?
A. Xuất hiện màu tím hồng của dung dịch KMnO4
B. Mất màu tím hồng và xuất hiện màu vàng
C. Mất màu vàng và xuất hiện màu tím hồng
D. Cả A, B và c đều không đúng
Lời giải:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + MnSO4 + 8H2O
→ Đáp án B
Câu 53. Chất rắn X tác dụng với dung dịch HNO3 loãng, dư thu được dung dịch Y chỉ chứa 1 muối, axit dư và sinh ra khí NO (sản phẩm khử duy nhất). Dãy các chất nào sau đây phù hợp với X
A. Cu; CuO; Fe(OH)2.
B. CuFeS2; Fe3O4; FeO.
C. FeCO3; Fe(OH)2; Fe(OH)3.
D. Fe; Cu2O; Fe3O4.
Lời giải:
Đáp án A có CuO không tạo NO
Đáp án B có CuFeS2 chắc chắn tạo nhiều hơn 1 muối,
Đáp án C có Fe(OH)3 không tạo NO
→ Đáp án D
Câu 54. Vàng bị hoà tan trong nước cường toan tạo thành
A. AuCl và khí NO.
B. AuCl3 và khí NO2.
C. AuCl và khí NO2.
D. AuCl3 và khí NO.
Lời giải:
Au + HNO3 + 3HCl → AlCl3 + NO + 2H2O
→ Đáp án A
Câu 55. Cho các dung dịch loãng: (1) FeCl3, (2) FeCl2, (3) H2SO4, (4) HNO3, (5) hỗn hợp gồm HCl và NaNO3. Những dung dịch phản ứng được với kim loại Cu là:
A. (1), (2), (3) B. (1), (3), (5)
C. (1), (4), (5) D. (1), (3), (4)
Lời giải:
Các dung dịch phản ứng với kim loại đồng là FeCl3, HNO3, hỗn hợp gồm HCl, NaNO3. Các phản ứng:
2FeCl3 + Cu → 2FeCl2 + CuCl2
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
3Cu + 2 NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
→ Đáp án C
Câu 56. Kim loại nào sau đây có tác dụng hấp thụ tia gama, ngăn cản chất phóng xạ ?
A. Pt B. Pd
C. Au D. Pb
Lời giải:
Chì(Pb) có tác dụng hấp thụ tia gama nên dùng ngăn cản chất phóng xạ
→ Đáp án D
Câu 57. Nung Fe(NO3)2 trong bình kín, không có không khí, thu được sản phẩm gồm
A. FeO, NO
B. Fe2O3, NO2 và O2
C. FeO, NO2 và O2
D. FeO, NO và O2
Lời giải:
4Fe(NO3)2 → 2Fe2O3 + 4NO2 + 5O2
→ Đáp án B
Câu 58. Cho Fe dư tác dụng với dung dịch HNO3 sau phản ứng dung dịch thu được chứa những chất tan nào ?
A. HNO3; Fe(NO3)2.
B. Fe(NO3)3.
C. Fe(NO3)2.
D. Fe(NO3)2 và Fe(NO3)3.
Lời giải:
Cho Fe dư tác dụng với dung dịch HNO3:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fedư + 2Fe(NO3)3 → 3Fe(NO3)2
→ Sau phản ứng thu được Fe(NO3)2
→ Đáp án C
Câu 59. Cho biết số hiệu nguyên tử của Ag là 47. Cho biết vị trí của Ag trong bảng tuần hoàn:
A. Ô 47, chu kì 5, nhóm IA
B. Ô 47, chu kì 5, nhóm IB
C. Ô 47, chu kì 4, nhóm IB
D. Ô 47, chu kì 6, nhóm IIB
Lời giải:
Ag có Z = 47. Cấu hình của Ag là [Kr]4d105s1
→ Ag ở ô 47, chu kì 5, e cuối cùng điền vào phân lớp 4d nên Ag ∈ IB
→ Đáp án B
Câu 60. Cấu hình nào sau đây là cấu hình thu gọn của nguyên tử nguyên tố sắt (Z = 26) ?
A. [Ar] 3d8
B. [Ar] 3d74s1
C. [Ar] 3d64s2
D. [Ar]3d54s24p1
Lời giải:
Cấu hình của nguyên tố sắt Z = 26: 1s22s22p63s23p63d64s2 → Cấu hình thu gọn là [Ar]3d64s2
→ Đáp án C
Câu 61. Cho các chất sau (Fe, Fe2O3, Al, axit HCl, dung dịch NaOH) tác dụng với nhau từng đôi một, số phản ứng xảy ra là:
A. 3 B. 4
C. 5 D. 6
Lời giải:
1, Fe + 2HCl → FeCl2 + H2
2, Fe2O3 + 6HCl → 2FeCl3 + 3H2O
3, Al + 6HCl → 2AlCl3 + 3H2
4, Al + NaOH + H2O → NaAlO2 + 3/2 H2
5, HCl + NaOH → NaCl + H2O
→ Đáp án C
Câu 62. Hỗn hợp kim loại nào sau đây tất cả đều tham gia phản ứng trực tiếp với muối sắt (III) trong dung dịch ?
A. Na, Al, Zn
B. Fe, Mg, Cu
C. Ba, Mg, Ni
D. K, Ca, Al
Lời giải:
Nhận thấy các kim loại Na, Ba, K khi tác dụng vào các dung dịch muối sắt (III) sẽ phản ứng với nước trước tạo hidroxit, sau đó hidroxit mới phản ứng với muối sắt (III).
→ Đáp án B
Câu 63. Cho một miếng Fe vào cốc đựng H2SO4 loãng. Bọt khí H2 sẽ bay ra nhanh hơn khi thêm vào cốc trên dung dịch nào trong các dung dịch sau:
A. HgSO4 B. Na2SO4
C. Al2(SO4)3 D. MgSO4
Lời giải:
Ban đầu, Fe tiếp xúc trực tiếp với ion H+ của axit, sắt bị ăn mòn hóa học theo phản ứng:
Fe + 2H+ → Fe2+ + H2↑
Khi H2 sinh ra bám vào bề mặt là sắt, ngăn cản tiếp xúc giữa Fe và H+, giảm tốc độ phản ứng.
• Khi thêm vài giọt HgSO4 vào, vì tính oxi hóa Hg2+ vào, vì tính oxi hóa Hg2+ > H+, nên có phản ứng: Fe + Hg2+ → Fe2+ + Hg.
Hg tạo ra bám vào Fe tạo thành hai điện cực (pin điện) và Fe bị ăn mòn điện hóa, vì tính khử Fe > Hg: Cực âm (Fe): Fe → Fe2+ + 2e, Cực dương (Hg): 2H+ + 2e → H2↑
Khí thoát ra ở cực Hg, nên Fe bị ăn mòn nhanh hơn
→ Đáp án A
Câu 64. Hỗn hợp X gồm Ag, Fe, Cu. Ngâm X trong dd chỉ chứa một chất tan Y, khuấy kỹ để pư xảy ra hoàn toàn, thấy còn lại một kim loại có khối lượng không đổi so với ban đầu. Biết Y tạo kết tủa với dd BaCl2. Chất Y là
A. AgNO3. B. Fe2(SO4)3.
C. HCl. D. H2SO4.
Lời giải:
Nếu Y là AgNO3 thì thu được kim loại Ag sẽ có khối lượng lớn hơn khối lượng ban đầu
Nếu là Fe2(SO4)3 thì Fe, Cu tan, còn Ag không tan, có khối lượng không đổi
Nếu là HCl, H2SO4 thì cả Cu và Ag đều không tan nên sẽ thu được 2 kim loại
→ Đáp án B
Câu 65. Dung dịch HI có thể khử được ion nào sau đây ?
A. Fe2+ B. Fe3+
C. Cu2+ D. Al3+
Lời giải:
Ion I- có tính khử mạnh có khả năng phản ứng với Fe3+ có tính oxi hóa hình thành Fe2+
2I- + Fe3+ → Fe2+ + I2.
I- không có khả năng khử Fe2+, Cu2+, Al3+ về Fe, Cu, Al.
→ Đáp án B
Câu 66. Phát biểu nào sau đây không đúng?
A. Tính chất của sắt là tính khử.
B. Sắt tác dung với dung dịch HCl và dung dịch H2SO4 loãng cho muối sắt (II).
C. Sắt thụ động trong dung dịch HNO3 đặc nguội và H2SO4 đặc nguội.
D. Sắt tác dụng với dung dịch HNO3 loãng thu được muối và khí hiđro.
Lời giải:
Fe + 4HNO3(loãng) -to→ Fe(NO3)3 + NO + 2H2O
→ Đáp án D
Câu 67. Cho biết số hiệu nguyên tử của Zn là 30. Cho biết vị trí của Zn trong bảng tuần hoàn:
A. Ô 30, chu kì 4, nhóm IIA
B. Ô 30, chu kì 5, nhóm IIB
C. Ô 30, chu kì 4, nhóm IIB
D. Ô 30, chu kì 3 nhóm IIB
Lời giải:
Zn: [Ar] 3d104s2 ở ô 30, chu kì 4, nhóm IIB
→ Đáp án C
Câu 68. Chọn câu trả lời đúng. Trong bảng tuần hoàn các nguyên tố hoá học, vị trí của nguyên tố Fe là
A. Số thứ tự 26, chu kỳ 4, nhóm VIIB, sắt là nguyên tố kim loại nhóm B.
B. Số thứ tự 26, chu kỳ 4, nhóm VIB, sắt là nguyên tố phi kim.
C. Số thứ tự 26, chu kỳ 4, nhóm VIIIB, sắt là nguyên tố kim loại nhóm B.
D. Số thứ tự 26, chu kỳ 4, nhóm VB, sắt là kim loại nhóm B.
Lời giải:
Cấu hình của nguyên tố sắt Z = 26: 1s22s22p63s23p63d64s2 → Sắt có số thứ tự 26, chu kỳ 4.
Sắt có 8e hóa trị, e cuối cùng điền vào phần lớp d → Sắt thuộc nhóm VIIIB, là nguyên tố kim loại nhóm B
→ Đáp án C
Câu 69. Chất rắn X phản ứng với dung dịch HCl được dung dịch Y. Cho từ từ dung dịch NH3 đến dư vào dung dịch Y, ban đầu xuất hiện kết tủa xanh, sau đó kết tủa tan, thu được dung dịch màu xanh thẫm. Chất X là:
A. FeO B. Fe
C. CuO D. Cu
Lời giải:
- Rắn X phản ứng với dd HCl:
FeO + 2HCl → FeCl2 + H2O
Fe + 2HCl → FeCl2 + H2
CuO + 2HCl → CuCl2 + H2O
Cu + HCl → không xảy ra
- Dung dịch X:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
Fe(OH)2 + NH3 → không xảy ra
CuCl2 + 2NH3 + 2H2O → Cu(OH)2↓ + 2NH4Cl
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Dung dịch màu xanh thẫm
→ Đáp án C
Câu 70. Cho các phản ứng:
(1) Cu2O + Cu2S →
(2) Cu(NO3)2 →
(3) CuO + CO →
(4) CuO + NH3 →
Số phản ứng tạo ra kim loại Cu là:
A. 23 B. 3
C. 1 D. 4
Lời giải:
(1): 2Cu2O + Cu2S → 6Cu + SO2
(2): Cu(NO3)2 -to→ CuO + 2NO2 + 1/2 O2
(3): CuO + CO -to→ Cu + CO2
(4): 3CuO + 2NH3 -to→ 3Cu + N2 + 3H2O
→ Đáp án D
Câu 71. Muối sắt được dùng làm chất diệt sâu bọ có hại cho thực vật là
A. FeCl3 B. FeCl2
C. FeSO4 D. (NH4)SO4.Fe2(SO4)3.24H2O
Lời giải:
Muối FeSO4 được dùng làm chất diệt sâu bọ có hại cho thực vật, pha chế sơn, mực và dùng trong kĩ thuật nhuộm vải.
• Muối FeCl3 được dùng làm chất xúc tác trong một số phản ứng hữu cơ.
• Fe2(SO4) có trong phèn sắt-amoni, tức muối kép sắt(III) amoni sunfat (NH4)2SO4.Fe2(SO4)3.24H2O.
• Fe2O3 được dùng để pha chế sơn chống gỉ.
→ Đáp án C
Câu 72. Trong các phản ứng sau phản ứng nào sai:
A. Fe + 2HCldd → FeCl2 + H2
B. Fe + CuSO4dd → FeSO4 + Cu
C. Fe + Cl2 → FeCl2
D. 3Fe + 2O2 → Fe3O4
Lời giải:
Các Đáp án A, B, D đúng.
Đáp án C sai vì 2Fe + 3Cl2 → 2FeCl3
→ Đáp án C
Câu 73. Có các cặp chất sau: Cu và dung dịch FeCl3; H2S và dung dịch CuSO4; H2S và dung dịch FeCl3; dung dịch AgNO3 và dung dịch FeCl3. Số cặp chất xảy ra phản ứng ở điều kiện thường là:
A. 2 B. 3
C. 4 D. 1
Lời giải:
Các cặp chất xảy ra phản ứng
Cu + 2FeCl3 → CuCl2 + 2FeCl2
H2S + CuSO4 → CuS + H2SO4
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
3AgNO3 + FeCl3 → 3AgCl + Fe(NO3)3
→ Đáp án C
Câu 74. Trong các cặp kim loại sau, cặp kim loại nào gồm hai nguyên tố không thuộc cùng một nhóm trong bảng tuần hoàn ?
A. Ni, Zn B. Cu, Au
C. Sn, Pb D. Cu, Ag
Lời giải:
Cu và Au cùng thuộc nhóm IB
Sn và Pb cùng thuộc nhóm VIA
Cu và Ag cùng thuộc nhóm IB
Ni thuộc nhóm VIIIB, Zn thuộc nhóm IIB
→ Đáp án A
Câu 75. Phát biểu nào sau đây không đúng?
A. Trong môi trường kiềm, muối Cr(III) có tính khử và bị các chất oxi hóa mạnh chuyển thành muối Cr(VI).
B. Do Pb2+/Pb đứng trước 2H+/H2 trong dãy điện hóa nên Pb dễ dàng phản ứng với dung dịch HCl loãng nguôi, giải phóng khí H2.
C. CuO nung nóng khi tác dụng với NH3 hoặc CO, đều thu được Cu.
D. Ag không phản ứng với dung dịch H2SO4 loãng nhưng phản ứng với dung dịch H2SO4 đặc nóng.
Lời giải:
- Trong môi trường kiềm, muối Cr (III) có tính khử và bị các chất oxi hóa mạnh chuyển thành muối Cr (VI) → đáp án A đúng.
Ví dụ: 2CrCl3 + 3Cl2 + 16NaOH → 2Na2CrO4 + 12NaCl + 8H2O
- Pb2+/Pb đứng trước 2H+/H2 trong dãy điện hóa nên Pb phản ứng được vơi dung dịch HCl loãng nguội, giải phóng khí H2. Nhưng PbCl2 sinh ra ít tan bao phía ngoài Pb nên thực tế phản ứng không xảy ra. → Đáp án B sai.
- CuO nung nóng khi tác dụng với NH3 hoặc CO, đều thu được Cu → Đáp án C đúng.
3CuO + 2NH3 -to→ 3Cu + N2 + 3H2O
CuO + CO -to→ Cu + CO2
- Ag không phản ứng với dung dịch H2SO4 loãng nhưng phản ứng với dung dịch H2SO4 đặc nóng → Đáp án D đúng.
2Ag + 2H2SO4 -to→ Ag2SO4 + SO2 + 2H2O
→ Đáp án B
Câu 76. Thực hiện các phản ứng sau:
(1) Fe + dung dịch HCl
(2) Fe + Cl2
(3) dung dịch FeCl2 + Cl2
(4) Fe3O4 + dung dịch HCl
(5) Fe(NO3)2 + HCl
(6) dung dịch FeCl2 + KI
Các phản ứng có thể tạo thành FeCl3 là:
A. 1, 2, 3, 4
B. 2, 3, 4, 5
C. Chỉ 2, 3
D. Chỉ trừ 1
Lời giải:
Fe+ 2HCl → FeCl2 + H2 (1)
2Fe + 3Cl2dư → 2FeCl3 (2)
2FeCl2 + Cl2 → 2FeCl3 (3)
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O (4)
9Fe(NO3)2 + 12HCl→ 4FeCl3 + 5Fe(NO3)3 + 3NO + 6H2O (5)
FeCl2 + KI → không xảy ra phản ứng.
→ Đáp án B
Câu 77. Nhúng các thanh Fe giống nhau lần lượt vào các dung dịch: AgNO3 (1), Al(NO3)3 (2), Cu(NO3)2 (3), Fe(NO3)3 (4). Các dung dịch có thể phản ứng với Fe là
A. 1 và 3
B. 1 và 2
C. 1,3 và 4
D. 1, 2, 3 và 4
Lời giải:
Fe + 3AgNO3 (dư) → Fe(NO3)3 + 3Ag↓
Fe + Al(NO3)3 → không phản ứng.
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
→ Fe có thể phản ứng với các dung dịch (1), (3), (4)
→ Đáp án C
Câu 78. Đồng không tan được trong những dung dịch nào dưới đây?
A. dung dịch HCl có hòa tan O2
B. dung dịch FeCl3
C. dung dịch NH3 dư
D. dung dịch AgNO3
Lời giải:
∗Chú ý: Chỉ có Cu(OH)2 mới tan trong dung dịch NH3 dư do tạo phức còn Cu và CuO thì không phản ứng.
→ Đáp án C
Câu 79. Trong các kim loại sau, kim loại nào có tính dẻo cao nhất ?
A. Ag B. Al
C. Au D. Sn
Lời giải:
Tính dẻo giảm dần: Au, Ag, Al, Cu, Sn,... Người ta có thể dát được những lá vàng mỏng tới 1/20 micromet, ánh sáng có thể đi qua được.
→ Đáp án C
Câu 80. Hòa tan một oxit sắt vào dung dịch H2SO4 loãng dư được dung dịch X. Chia dung dịch X làm 2 phần bằng nhau:
- Phần 1: Cho một ít vụn Cu vào thấy tan ra và cho dung dịch có màu xanh
- Phần 2: Cho một vài giọt dung dịch KMnO4 vào thấy bị mất màu.
Oxit sắt là
A. FeO
B. Fe3O4
C. Fe2O3
D. FeO hoặc Fe2O3.
Lời giải:
Dung dịch X phản ứng được với Cu → dung dịch X chứa ion Fe3+
Dung dịch X phản ứng với KMnO4 → dung dịch X chứa ion Fe2+
Vậy oxit sắt có công thức Fe3O4.
→ Đáp án B
Bài giảng: Bài tập sắt, hợp chất của sắt tác dụng với chất oxi hóa mạnh - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (cơ bản – phần 1)
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (cơ bản – phần 3)
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (cơ bản – phần 4)
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (nâng cao – phần 1)
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (nâng cao – phần 2)
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (nâng cao – phần 3)
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (nâng cao – phần 4)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

