Chuyên đề dạy thêm Hóa học 10 Chân trời sáng tạo (có lời giải)
Tài liệu chuyên đề dạy thêm Hóa học 10 sách Chân trời sáng tạo gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa 10.
Chuyên đề dạy thêm Hóa học 10 Chân trời sáng tạo (có lời giải)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thử Chuyên đề dạy thêm Hóa 10 Xem thử Các dạng bài tập Hóa 10 Xem thử Vở ghi bài Hóa 10
Chỉ từ 450k mua trọn Chuyên đề dạy thêm Hóa 10; Các dạng bài tập Hóa 10; Vở ghi Hóa 10 bản word có lời giải chi tiết:
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 10 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Chuyên đề dạy thêm Hóa học 10 Chân trời sáng tạo gồm 7 Chương với nhiều dạng bài đa dạng và bài tập đầy đủ các mức độ:
Xem thử chuyên đề Hóa học 10 KNTT
Chuyên đề Liên kết hóa học lớp 10
A. PHẦN LÍ THUYẾT
I. LÍ THUYẾT TRỌNG TÂM BÀI 8: QUY TẮC OCTET
* Liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
* Quy tắc octet
Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
* Lưu ý:
Không phải mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đều tuân theo quy tắc octet. Người ta nhận thấy một số phân tử không tuân theo quy tắc octet. Ví dụ: NO, BH3, SF6,…
II. ĐỀ TỰ LUYỆN PHẦN LÍ THUYẾT
2.1. Phần tự luận
Câu 1: Biết phân tử magnesium oxide được hình thành bởi các ion Mg2+ và O2–. Vận dụng quy tắc octet, trình bày sự hình thành các ion trên từ những nguyên tử tương ứng.
Câu 2: Cho các nguyên tử của các nguyên tố sau:
Na (Z = 11), Cl (Z = 17), Ne (Z = 10) và Ar (Z = 18).
Những nguyên tử nào trong các nguyên tử trên có lớp electron bền vững?
Câu 3: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Viết số electron theo lớp quá trình các nguyên tử nhường, nhận electron để tạo ion.
a) K (Z = 19) và O (Z = 8).
b) Li (Z = 3) và F (Z = 9).
c) Mg (Z = 12) và P (Z = 15).
Câu 4: Cấu hình electron lớp ngoài cùng của nguyên tử potassium (K) là 4s1, cấu hình electron lớp ngoài cùng của nguyên tử bromine (Br) là 4s24p5. Làm thế nào các nguyên tử K và Br có được cấu hình electron của nguyên tử khí hiếm theo quy tắc octet.
Câu 5: Cho một số hydrocarbon sau: H–C≡C–H; H2C=CH2 và H3C–CH3.
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet?
b) Một phân tử hydrocarbon có 3 nguyên tử C và x nguyên tử H. Giá trị x lớn nhất có thể là bao nhiêu?
Câu 6: PH3 (phosphine), P2H4 (diphosphine) xuất hiện do sự phân hủy xương, xác động thực vật ở khu vực như đầm lầy, nghĩa địa. P2H4 là chất có khả năng tự cháy trong không khí, khi cháy nó tạo ra nhiệt lượng làm tăng nhiệt độ lên đến khoảng 150 oC sau đó PH3 tiếp tục cháy và kết quả là xuất hiện “ngọn lửa ma trơi”.
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine.
Câu 7: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: H2O, F2, CCl4 và NF3.
Câu 8: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: O2, CO2, CaCl2 và KCl.
Câu 9: Đá vôi (thành phần chính là CaCO3) được dùng để sản xuất vôi, trong lĩnh vực xây dựng,… Barium nitrate có trong thành phần của kính quang học, gốm, men,… Phèn đơn aluminium sulfate (thành phần chính là Al2(SO4)3) được sử dụng rộng rãi trong xử lí nước thải, trong công nghệ sản xuất giấy, công nghệ nhuộm vải và công nghệ lọc nước và nuôi trồng thủy sản,… Dựa vào quy tắc octet, đề xuất công thức cấu tạo của các chất trên.
Câu 10: Hợp chất X tạo bởi hai nguyên tố A, D có khối lượng phân tử là 76. X là dung môi không phân cực, thường được sử dụng để làm nguyên liệu trong tổng hợp chất hữu cơ chứa sulfur và được sử dụng rộng rãi trong sản xuất vải viscoza mềm. A có công thức hydride dạng AH4 và A có công thức oxide ứng với hóa trị cao nhất dạng DO3.
a) Hãy thiết lập công thức phân tử của X. Biết rằng A có số oxi hóa cao nhất trong X.
b) Đề xuất công thức cấu tạo của X và cho biết các nguyên tử thành phần của X khi liên kết có đủ electron theo quy tắc octet hay không?
2.2. Đáp án phần tự luận
Câu 1: Biết phân tử magnesium oxide được hình thành bởi các ion Mg2+ và O2–. Vận dụng quy tắc octet, trình bày sự hình thành các ion trên từ những nguyên tử tương ứng.
Đáp án:
* Mg (Z = 12): 1s22s22p63s2 (có 2 electron lớp ngoài cùng):
* O (Z = 8): 1s22s22p4 (có 6 electron lớp ngoài cùng):
Câu 2: Cho các nguyên tử của các nguyên tố sau: Na (Z = 11), Cl (Z = 17), Ne (Z = 10) và Ar (Z = 18). Những nguyên tử nào trong các nguyên tử trên có lớp electron bền vững?
Đáp án:
+ Na (Z = 11): 1s22s22p63s1;
+ Cl (Z = 17): 1s22s22p63s23p5;
+ Ne (Z = 10): 1s22s22p6;
+ Ar (Z = 18): 1s22s22p63s23p6.
Nguyên tử Ne và Ar có 8 electron bền vững.
Câu 3: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Viết số electron theo lớp quá trình các nguyên tử nhường, nhận electron để tạo ion.
a) K (Z = 19) và O (Z = 8).
b) Li (Z = 3) và F (Z = 9).
c) Mg (Z = 12) và P (Z = 15).
Đáp án:
Câu 4: Cấu hình electron lớp ngoài cùng của nguyên tử potassium (K) là 4s1, cấu hình electron lớp ngoài cùng của nguyên tử bromine (Br) là 4s24p5. Làm thế nào các nguyên tử K và Br có được cấu hình electron của nguyên tử khí hiếm theo quy tắc octet.
Đáp án:
* K (Z = 19): 1s22s22p63s23p64s1 (có 1 electron lớp ngoài cùng):
* Br (Z = 35): 1s22s22p63s23p63d104s24p5 (có 7 electron lớp ngoài cùng):
Câu 5: Cho một số hydrocarbon sau: H–C≡C–H; H2C=CH2 và H3C–CH3.
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet?
b) Một phân tử hydrocarbon có 3 nguyên tử C và x nguyên tử H. Giá trị x lớn nhất có thể là bao nhiêu?
Đáp án:
a) Ta có, mỗi gạch trong các công thức biểu diễn hai electron hóa trị chung, do đó mỗi C đã đủ 8 electron ở lớp ngoài cùng; mỗi H đã đủ 2 electron ở lớp ngoài cùng (thõa mãn quy tắc octet).
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H: C3Hx
⇒ Tổng số electron hoá trị là 3.4 = 12.
⇒ Tổng số liên kết đơn giữa các nguyên tử C là: 3 – 1 = 2 ⇒ tổng số electron tham gia tạo liên kết là 2.2 = 4.
⇒ Số H tối đa: x = 12 – 4 = 8.
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong Chuyên đề dạy thêm Hóa 10 Chân trời sáng tạo. Để mua tài liệu, mời Thầy/Cô xem thử:
Xem thử chuyên đề Hóa học 10 KNTT
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm đề thi lớp 10 các môn học có đáp án hay khác:
Tài liệu giáo án lớp 10 các môn học chuẩn khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

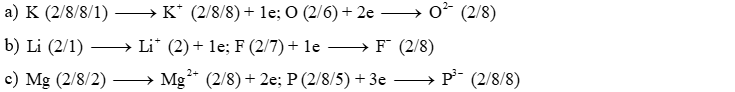



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

