Liên kết hóa học là gì (chi tiết nhất)
Bài viết Liên kết hóa học là gì lớp 10 chi tiết nhất là kiến thức có trong chương trình Hóa học 10 giúp học sinh nắm vững kiến thức trọng tâm về Liên kết hóa học.
Liên kết hóa học là gì (chi tiết nhất)
1. Liên kết hóa học là gì?
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
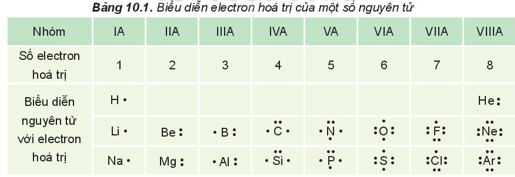
- Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết (electron hóa trị).
- Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
2. Kiến thức mở rộng
- Quy tắc octet (bát tử): Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
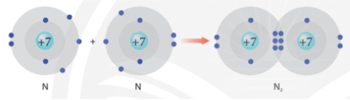
- Ví dụ 1: Vận dụng quy tắc octet trong sự hình thành phân tử nitrogen (N2)
Liên kết giữa 2 nguyên tử nitrogen (N) trong phân tử nitrogen (N2) được tạo thành do mỗi nguyên tử N đã góp chung 3 electron hóa trị, tạo nên 3 cặp electron chung.
Phân tử N2 được biểu diễn: xung quanh mỗi nguyên tử N đều có 8 electron.
- Ví dụ 2: Vận dụng quy tắc octet trong sự tạo thành phân tử NaF.
Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử sodium sẽ tạo thành hạt mang điện dương, có cấu hình electron bền vững, giống với khí hiếm gần nhất là Ne.
Viết gọn: Na → Na+ + 1e
Nguyên tử fluorine có 7 electron ở lớp ngoài cùng. Khi nhận vào 1 electron nguyên tử fluorine sẽ tạo thành hạt mang điện âm, có cấu hình electron bền vững giống khí hiếm Ne.
Viết gọn: F + 1e → F-
Các hạt tạo thành Na+; F- có điện tích trái dấu hút nhau tạo nên phân tử NaF.
3. Bài tập minh họa
Câu 1. Liên kết hóa học là
A. sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Hướng dẫn giải
Đáp án đúng là: B
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 2. Theo quy tắc octet, khi hình thành liên kết hóa học các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
A. kim loại kiềm gần kề.
B. kim loại kiềm thổ gần kề.
C. nguyên tử halogen gần kề.
D. nguyên tử khí hiếm gần kề.
Hướng dẫn giải
Đáp án đúng là: D
Theo quy tắc octet, khi hình thành liên kết hóa học các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như nguyên tử khí hiếm gần kề.
Câu 3. Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải nhường đi
A. 2 electron.
B. 3 electron.
C. 1 electron.
D. 4 electron.
Hướng dẫn giải
Đáp án đúng là: C
Cấu hình e: 1s22s22p63s23p64s1 ⟹ nhường đi 1 electron lớp ngoài cùng để có cấu hình giống khí hiếm Argon
Câu 4. Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải
Đáp án đúng là: C
⇒ Có 4 cặp electron ngoài cùng của C và S chưa tham gia liên kết.
Câu 5. Công thức electron nào sau đây không đủ electron theo quy tắc octet?
A.
B.
C.
D.
Hướng dẫn giải
Đáp án đúng là: B
Trong BH3 thì B chỉ có 6 electron nên không đủ electron theo quy tắc octet (8 electron).
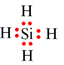
Câu 6. Phân tử nào sau đây có các nguyên tử đều đạt cấu hình electron bão hòa theo quy tắc octet?
A. BeH2.
B. AlCl3.
C. PCl5.
D. SiH4.
Hướng dẫn giải
Đáp án đúng là: D
BeH2 |
AlCl3 |
PCl5 |
SiH4 |
|
Be chỉ có 4 electron |
Al chỉ có 6 electron |
P có 10 electron |
Si, H đều thỏa mãn quy tắc octet |
Câu 7. Quy tắc octet không đúng với trường hợp phân tử nào sau đây?
A. H2O
B. NO2.
C. CO2.
D. Cl2
Hướng dẫn giải
Đáp án đúng là: B
H2O |
NO2 |
CO2 |
Cl2 |
⇒ Trong NO2 thì N chỉ có 7 electron lớp ngoài cùng ⇒ không thỏa mãn quy tắc octet.
Câu 8.Nguyên tử trong phần tử nào dưới đây ngoại lệ với quy tắc octet?
A. H2O.
B. NH3.
C. HCl
D. BF3.
Hướng dẫn giải
Đáp án đúng là: D
H2O |
NH3 |
HCl |
BF3 |
Câu 9. Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
A. Aluminium
B. Nitrogen
C. Phosphorus
D. Oxygen
Hướng dẫn giải
Đáp án đúng là: C
Đếm số electron: 15 ⟹ Phosphorus
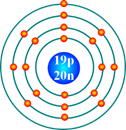
Câu 10.Nguyên tử có mô hình cấu tạo sau đây có xu hướng nhường hoặc nhận electron như thế nào khi hình thành liên kết hóa học ?
A. Nhận 1 electron.
B. Nhường 1 electron.
C. Nhận 7 electron.
D. Nhường 7 electron.
Hướng dẫn giải
Đáp án đúng là: B
Nguyên tử trên có 1 electron lớp ngoài cùng ⟹ nhường 1 electron.
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều



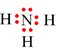





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

