Nhiệt hình thành chuẩn là gì (chi tiết nhất)
Bài viết Nhiệt hình thành chuẩn là gì lớp 10 chi tiết nhất là kiến thức có trong chương trình Hóa học 10 giúp học sinh nắm vững kiến thức trọng tâm về Nhiệt hình thành chuẩn.
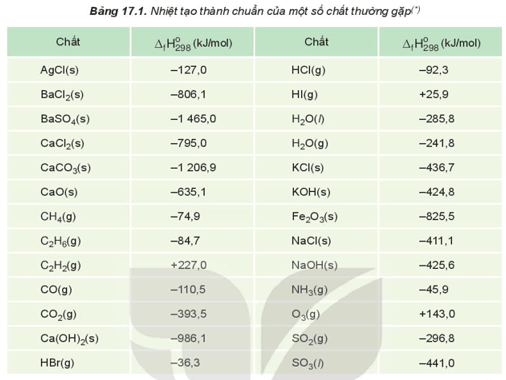
Nhiệt hình thành chuẩn là gì (chi tiết nhất)
1. Nhiệt hình thành chuẩn là gì?
Nhiệt tạo thành chuẩn là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất ở điều kiện chuẩn.
Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0, ví dụ:
2. Kiến thức mở rộng
Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành:
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cd).
Ở điều kiện chuẩn:
Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hóa học.
Ví dụ: Hãy xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane:
Biết: Nhiệt tạo thành chuẩn C2H6; O2; CO2; H2O của lần lượt là: −84,7 kJ/mol; 0 kJ/mol; −393,5 kJ/mol; −285,8 kJ/mol.
Hướng dẫn:
Tổng nhiệt tạo thành các chất đầu là:
Tổng nhiệt tạo thành các chất sản phẩm là:
Biến thiên enthalpy của phản ứng:
3. Bài tập minh họa
Câu 1. Điều kiện nào sau đây là điều kiện chuẩn đối với chất khí?
A. Áp suất 1 bar và nhiệt độ 25 oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 298K.
C. Áp suất 1 bar và nhiệt độ 25 oC.
D. Áp suất 1 bar và nhiệt độ 25K.
Hướng dẫn giải
Đáp án đúng là: A
Điều kiện chuẩn đối với chất khí là áp suất 1 bar và nhiệt độ 25 oC hay 298K.
Câu 2. Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành 1 mol chất đó từ chất nào ở điều kiện chuẩn?
A. những hợp chất bền vững nhất.
B. những đơn chất bền vững nhất.
C. những oxide có hóa trị cao nhất.
D. những dạng tồn tại bền nhất trong tự nhiên.
Hướng dẫn giải
Đáp án đúng là: B
Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành 1 mol chất đó từ những đơn chất bền vững nhất ở điều kiện chuẩn
Câu 3. Kí hiệu enthalpy tạo thành (nhiệt tạo thành) của phản ứng ở điều kiện chuẩn là
A.
B.
C.
D.
Hướng dẫn giải
Đáp án đúng là: B
Kí hiệu enthalpy tạo thành (nhiệt tạo thành) của phản ứng ở điều kiện chuẩn là
Câu 4. Enthalpy tạo thành chuẩn của một đơn chất bền
A. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với oxygen.
C. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
D. bằng 0.
Hướng dẫn giải
Đáp án đúng là: D
Enthalpy tạo thành chuẩn của một đơn chất bền bằng 0.
Câu 5. Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO (g) + O2 (g) CO2 (g)
Biết nhiệt tạo thành chuẩn của CO2:
Nhiệt tạo thành chuẩn của CO là
A. −110,5 kJ.
B. +110,5 kJ.
C. −141,5 kJ.
D. −221,0 kJ.
Hướng dẫn giải
Đáp án đúng là: D
Câu 6. Cho phản ứng sau: 2SO2 (g) + O2 (g) 2SO3 (g)
Biết ,
Biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn có giá trị là
A. –98,89 kJ.
B. –197,78 kJ.
C. 98,89 kJ.
D. 197,78 kJ.
Hướng dẫn giải
Đáp án đúng là: B
= 2.( −395,72) – 2.( −296,83) – 0 = −197,78 kJ.
Câu 7. Cho phản ứng hoá học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) N2O4(g) (không màu)
Biết NO2 và N2O4 có tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. toả nhiệt, NO2 bền vững hơn N2O4.
B. thu nhiệt, NO2 bền vững hơn N2O4.
C. toả nhiệt, N2O4 bền vững hơn NO2.
D. thu nhiệt, N2O4 bền vững hơn NO2.
Hướng dẫn giải
Đáp án đúng là: C
= 9,16 – 2.33,18 = –57,2 (kJ) < 0.
⇒ Phản ứng toả nhiệt, N2O4 bền hơn NO2
Câu 8. Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4 (g) + 2O2 (g) CO2 (g) + 2H2O (l)
Biết nhiệt tạo thành chuẩn của CO2 (g) và H2O (l) tương ứng là −393,5 kJ/mol và −285,8 kJ/mol.
Nhiệt tạo thành chuẩn của khí methane là
A. 0 kJ.
B. –74,8 kJ.
C. 890,3 kJ.
D. 74,8 kJ.
Hướng dẫn giải
Đáp án đúng là: B
Ta có:
⟺ − 890,3 = (−393,5) + 2.(−285,8) −
⟹ = 890,3 – 393,5 + 2.(−285,8) = − 74,8 kJ/mol
Lưu ý: = 0 kJ/mol
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

