Phản ứng thu nhiệt là gì (chi tiết nhất)
Bài viết Phản ứng thu nhiệt là gì lớp 10 chi tiết nhất là kiến thức có trong chương trình Hóa học 10 giúp học sinh nắm vững kiến thức trọng tâm về Phản ứng thu nhiệt.
Phản ứng thu nhiệt là gì (chi tiết nhất)
1. Phản ứng thu nhiệt là gì?
- Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Ví dụ: Các phản ứng trong lò nung vôi, nung clinker xi măng, … là các phản ứng thu nhiệt.
2. Kiến thức mở rộng
2.1. Biến thiên enthalpy
- Biến thiên enthalpy của phản ứng (nhiệt phản ứng), kí hiệu là ∆rH là nhiệt lượng tỏa ra hay thu vào của phản ứng ở một điều kiện xác định.
- Phương trình hóa học kèm theo trạng thái của các chất và giá trị ∆rH gọi là phương trình nhiệt hóa học.
- Ví dụ: Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol CH4, sản phẩm là CO2(g) và H2O(l), thì sẽ giải phóng một nhiệt lượng là 890 kJ.
Như vậy phản ứng có biến thiên enthalpy = –890 kJ và được biểu diễn bằng phương trình nhiệt hóa học như sau:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l); = –890 kJ
2.2. Biến thiên enthalpy chuẩn
- Biến thiên enthalpy chuẩn của một phản ứng hóa học, kí hiệu là , chính là lượng nhiệt (tỏa ra hoặc thu vào) của phản ứng đó ở điều kiện chuẩn.
- Chú ý: Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K (25oC).
2.3. Ý nghĩa của biến thiên enthalpy
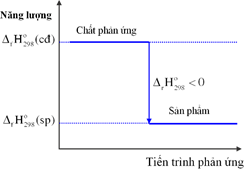
- Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt:
∆rH > 0: phản ứng thu nhiệt.
∆rH < 0: phản ứng tỏa nhiệt.
- Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
- Ví dụ: Cho phản ứng đốt cháy methane và acetylene:
(1) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l); = –890 kJ
(2) C2H2(g) + O2(g) → 2CO2(g) + H2O(l); = –1300,02 kJ
Khi đốt cháy cùng một thể tích khí CH4 và C2H2, lượng nhiệt do C2H2 sinh ra nhiều gấp khoảng 1,5 lần lượng nhiệt do CH4 sinh ra.
3. Bài tập minh họa
Câu 1. Cho các phát biểu:
(a) Tất cả các phản ứng cháy đều tỏa nhiệt.
(b) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt.
(d) Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(e) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
(g) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần khơi mào.
Số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải
Đáp án đúng là: B
Bao gồm: a, b, d.
(c) Sai ví dụ phản ứng nung vôi: CaCO3 (s) → CaO(s) + CO2(g) là phản ứng thu nhiệt
(e) Sai vì nhiệt phản ứng phụ thuộc vào điều kiện thực hiện phản ứng và trạng thái của chất.
(g) Sai vì đây là những ví dụ về phản ứng tỏa nhiệt.
Câu 2. Cho các phát biểu sau:
(a) Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc tỏa nhiệt bằng cách đo nhiệt độ của phản ứng bằng một nhiệt kế.
(b) Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
(c) Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng tỏa nhiệt.
(d) Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng tỏa nhiệt.
(e) Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
Số phát biểu không đúng là
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải
Đáp án đúng là: A
Bao gồm: b, d.
(b) Sai vì phản ứng thu nhiệt thì nhiệt độ sẽ giảm đi.
(d) Sai vì phản ứng tỏa nhiệt thì nhiệt độ sẽ tăng lên.
Câu 3. Cho các phát biểu:
(a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và
(b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
(d) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
Số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 1.
Hướng dẫn giải
Đáp án đúng là: A
Bao gồm: b, d.
(a) Sai vì điều kiện chuẩn áp suất là 1 bar.
(c) Sai vì phản ứng làm môi trường xung quanh nóng lên là phản ứng tỏa nhiệt.
Câu 4. Những loại phản ứng nào sau đây cần phải cung cấp năng lượng trong quá trình phản ứng?
A. Phản ứng tạo gỉ kim loại.
B. Phản ứng oxi hóa glucose trong cơ thể.
C. Phản ứng nhiệt phân.
D. Phản ứng đốt cháy.
Hướng dẫn giải
Đáp án đúng là: C
Phản ứng nhiệt phân cần phải cung cấp năng lượng trong quá trình phản ứng.
Câu 5. Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới. Kết luận nào sau đây là đúng?
A. Phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là a kJ/mol.
D. Phản ứng thu nhiệt.
Hướng dẫn giải
Đáp án đúng là: A
Biến thiên elthapy < 0 nên phản ứng tỏa nhiệt.
Câu 6. Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) 2H2O(l); = −571,68kJ
Phản ứng trên là phản ứng
A. thu nhiệt.
B. tỏa nhiệt.
C. không có sự thay đổi năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Hướng dẫn giải
Đáp án đúng là: B
Biến thiên elthapy < 0 nên phản ứng tỏa nhiệt.
Câu 7. Cho phương trình nhiệt hóa học của phản ứng:
N2(g) + O2(g) 2NO(l); = +179,20kJ
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. tỏa nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.
Hướng dẫn giải
Đáp án đúng là: A
Biến thiên elthapy > 0 nên phản ứng thu nhiệt.
Câu 8.Phản ứng nào sau đây là phản ứng toả nhiệt?
A. Phản ứng nhiệt phân muối KNO3.
B. Phản ứng phân huỷ khí NH3.
C. Phản ứng oxi hoá glucose trong cơ thể.
D. Phản ứng hoà tan NH4Cl trong nước.
Hướng dẫn giải
Đáp án đúng là: C
Phản ứng oxi hoá glucose trong cơ thể là tỏa nhiệt.
Câu 9.Nung KNO3 lên 550℃ xảy ra phản ứng:
KNO3(s) KNO2(s) +
Phản ứng nhiệt phân KNO3 là phản ứng
A. toả nhiệt, có < 0.
B. thu nhiệt, có > 0.
C. toả nhiệt, có > 0.
D. thu nhiệt, có < 0.
Hướng dẫn giải
Đáp án đúng là: B
Phản ứng nhiệt phân KNO3 là phản ứng thu nhiệt, có > 0.
Câu 10. Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) 2NO(g); = +180kJ
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
B. Phản ứng tỏa nhiệt.
C. Phản ứng xảy ra thuận lợi ở điều kiện thường.
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Hướng dẫn giải
Đáp án đúng là: B
Biến thiên elthapy > 0 nên phản ứng thu nhiệt, có sự hấp thụ nhiệt năng từ môi trường.
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

