Trắc nghiệm Hóa học 12 Kết nối tri thức Bài 25 (có đáp án): Nguyên tố nhóm IIA
Với 18 câu hỏi trắc nghiệm Hóa học 12 Bài 25: Nguyên tố nhóm IIA có đáp án chi tiết đầy đủ các mức độ, có đúng sai, trả lời ngắn sách Kết nối tri thức sẽ giúp học sinh lớp 12 ôn luyện trắc nghiệm Hóa 12.
Trắc nghiệm Hóa học 12 Kết nối tri thức Bài 25 (có đáp án): Nguyên tố nhóm IIA
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn.
Câu 1. Nước cứng không gây tác hại nào sau đây?
A. Làm giảm khả năng tẩy rửa của xà phòng, làm cho quần áo mau mục nát.
B. Gây lãng phí nhiên liệu và mất an toàn cho các nồi hơi, làm tắc các đường ống nước nóng.
C. Gây ngộ độc cho nước uống.
D. Làm hỏng dung dịch pha chế, làm thực phẩm lâu chín và giảm mùi vị của thực phẩm.
Câu 2. Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là
A. 3.
B. 2.
C. 4.
D. 1.
Câu 3. Kim loại không phản ứng với nước là
A. Mg.
B. Ba.
C. Be.
D. Ca.
Câu 4. Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng sau đó kết tủa tan dần.
Câu 5. Kim loại nào khử nước chậm ở nhiệt độ thường, nhưng phản ứng mạnh với hơi nước ở nhiệt độ cao?
A. Mg.
B. Ca.
C. Al.
D. Ba.
Câu 6. Trong tự nhiên, calcium sulfate tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
A. vôi sống.
B. vôi tôi.
C. thạch cao sống.
D. đá vôi.
Câu 7. Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 biến đổi như thế nào?
A. Tăng dần.
B. Giảm dần.
C. Không có quy luật.
D. Không đổi.
Câu 8. Barium phản ứng với nước dễ dàng hơn so với magnesium ở điều kiện thường là do các nguyên nhân nào sau đây?
(1) Barium có tính khử mạnh hơn magnesium.
(2) Độ tan của barium hydroxide trong nước cao hơn nhiều so với magnesium hydroxide.
(3) Bọt khí hydrogen sinh ra bám trên bề mặt magnesium nhiều hơn, cản trở phản ứng tiếp diễn.
A. (1).
B. (1), (2) và (3).
C. (1) và (3).
D. (1) và (2).
Câu 9. Trong các mẫu nước cứng sau đây, nước cứng tạm thời là
A. dung dịch Ca(HCO3)2.
B. dung dịch MgSO4.
C. dung dịch CaCl2.
D. dung dịch Mg(NO3)2 .
Câu 10. Cho dãy chuyển hóa sau: Công thức của Y có thể là
A. CaO.
B. Ca(OH)2.
C. CaCO3.
D. Ca(HCO3)2.
Câu 11. Trong bảng Hệ thống tuần hoàn, sodium (IA) và magnesium (IIA) đứng kề nhau trong một chu kì. Thế điện cực chuẩn của cặp Mg2+/Mg bằng –2,356 V, của cặp Na+/Na bằng –2,710 V.
a. Mg và Na là các kim loại có tính khử mạnh.
b. Mg có tính khử mạnh hơn Na.
c. Mg và Na đều phản ứng mãnh liệt với nước ở điều kiện thường.
d. Ion Mg2+ có tính oxi hóa mạnh hơn ion Na+.
Câu 12. Các muối carbonate của kim loại nhóm IIA đều bị phân hủy bởi nhiệt:
MCO3(s) MO (s) + CO2 (g)
Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau:
|
Muối |
MgCO3 (s) |
CaCO3 (s) |
SrCO3 (s) |
BaCO3 (s) |
|
∆rH˚298 (kJ) |
100,70 |
179,20 |
234,60 |
271,50 |
a. Phản ứng phân hủy muối carbonate của các kim loại nhóm IIA trên đều là phản ứng thuận lợi về mặt năng lượng.
b. Độ bền nhiệt các muối carbonate của kim loại nhóm IIA tăng dần khi số hiệu nguyên tử của M tăng dần.
c. Khi để vôi bột (thành phần chính là CaO) lâu ngoài không khí có hiện tượng vôi bột dần bị chuyển hóa lại thành đá vôi (thành phần chính là CaCO3).
d. Để sản xuất 1 tấn vôi bột theo phương pháp thủ công, người ta nung đá vôi (có hàm lượng CaCO3 là 72%, còn lại là tạp chất trơ) với than đá (giả sử chỉ chứa carbon và tạp chất trơ), biết = 393,50 kJ.mol−1. Khi đó, thể tích khí CO2 tối thiểu đã thải ra môi trường ở điều kiện chuẩn nhiều hơn 82,0 m3.
Câu 13. Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất trồng, tẩy uế, sát trùng, xử lí nước thải,... Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quá trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn.
Xét một lò nung vôi công nghiệp sử dụng than đá làm nhiên liệu.
Giả thiết:
+ Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một lượng nhiệt là 1800 kJ.
+ Đốt cháy 1 kg than đá giải phóng ra một lượng nhiệt là 27000 kJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
+ Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
Tổng khối lượng (tấn) đá vôi và than đá mà lò nung vôi trên sử dụng mỗi ngày là bao nhiêu?
Câu 14. Nhiệt phân hoàn toàn 40 g một loại quặng dolomite có lẫn tạp chất trơ sinh ra 9,916 lít khí CO2 (điều kiện chuẩn). Thành phần phần trăm về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là bao nhiêu?
Câu 15. Ion Ca2+ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion Ca2+ không bình thường là dấu hiệu của bệnh để xác định nồng độ ion Ca2+ người ta lấy mẫu máu, sau đó kết tủa ion Ca2+ dưới dạng calcium oxalate (CaC2O4 ). Rồi cho calcium oxalate tác dụng với KMnO4 trong môi trường acid theo sơ đồ sau:
CaC2O4 + KMnO4 + H2SO4 CaSO4 + K2SO4 + MnSO4 + H2O + CO2
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2,05 mL dung dịch KMnO4 4,88.10−4 M. Nồng độ Ca2+ trong máu người đó (tính theo đơn vị mg/100mL máu) là
Phần II. Câu trắc nghiệm đúng sai.
Câu hỏi. Magnesium (Mg) là kim loại được ứng dụng để tạo các hợp kim nhẹ, bền, đặc biệt là cho ngành công nghiệp sản xuất ô tô và hàng không vũ trụ. Magnesium được sản xuất trong công nghiệp theo quá trình Pidgeon với nguyên liệu ban đầu là quặng dolomite. Quá trình được thực hiện qua các giai đoạn sau:
Giai đoạn 1. Nung quặng dolomite:
Giai đoạn 2. Dùng Si trong ferrosilicon làm chất khử trong điều kiện chân không:
Phản ứng chung của quá trình Pidgeon là:
a. Quá trình Pidgeon là quá trình thu nhiệt.
b. Phản ứng ở giai đoạn (2) thuộc phương pháp nhiệt luyện.
c. Phản ứng ở giai đoạn (2) chứng tỏ MgO có tính oxi hoá mạnh hơn CaO.
d. Nếu hiệu suất của quá trình là 90% thì cứ 1 tấn quặng dolomite sẽ điều chế được 120 kg kim loại magnesium.
Phần III. Trắc nghiệm yêu cầu trả lời ngắn
Câu 1. Ion Ca2+ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2 mL dung dịch potassium permanganate Xác định nồng độ ion calcium trong máu người đó bằng đơn vị máu.
Câu 2. Để đánh giá mức độ tự diễn biến của một phản ứng tại nhiệt độ T, người ta dựa vào đại lượng biến thiên năng lượng tự do Gibbs Nếu: phản ứng không tự xảy ra; : phản ứng tự xảy ra. Giá trị của đại lượng này được tính theo biểu thức:
Trong đó:
- T: nhiệt độ tính theo thang Kelvin (K);
- : Biến thiên enthalpy của phản ứng;
- : Biến thiên entropy của phản ứng (đại lượng đặc trưng cho độ mất trật tự của hệ ở một trạng thái và điều kiện xác định).
Tính giá trị thấp nhất của T (làm tròn đến hàng đơn vị) để phản ứng sau tự xảy ra:
CaCO₃(s) → CaO(s) + CO₂(g)
Cho biết: và nhiệt tạo thành chuẩn của các chất như sau:
|
Chất |
CaCO₃(s) |
CaO(s) |
CO₂(g) |
|
|
-1207,0 |
-635,0 |
-393,5 |
Giả sử của quá trình không phụ thuộc vào nhiệt độ.
Xem thêm câu hỏi trắc nghiệm Hóa học lớp 12 Kết nối tri thức có đáp án hay khác:
Trắc nghiệm Hóa học 12 Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Trắc nghiệm Hóa học 12 Bài 29: Một số tính chất và ứng dụng của phức chất
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 12 Kết nối tri thức
- Giải SBT Hóa học 12 Kết nối tri thức
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT

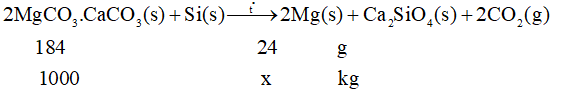



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

